Tabla de contenido
Actualizado – 18 de febrero de 2023
Este blog ya no continuará. El Blog Corona 2023 trata sobre antecedentes que han sido conocidos, particularmente de la industria farmacéutica y de instituciones de autoridad sanitaria a nivel internacional.
La actualización de datos es siempre la máxima prioridad aquí: a continuación encontrará artículos sobre diversos temas. abajo esta sección. La publicación más reciente está en la parte superior y tiene un título rojo.
Después de que se perdieron muchas actualizaciones debido a limitaciones de tiempo, a continuación se muestran animaciones en video de los datos relevantes a lo largo del tiempo desde el primer informe registrado de un efecto secundario hasta la fecha en orden cronológico, el más reciente primero. (Fuente: Programación de análisis de datos EMA / EMA).
- pericarditis
- Enfermedad de Creutzfeldt-Jakob
- Miocarditis
- trastorno menstrual
- Síndrome de Guillain-Barré
- parálisis de bell
- Trastorno del sueño
- Alucinación
- Trombocitopenia
- Aborto espontáneo
- dolor de ojos
- Pérdida de conciencia
- Narcolepsia
- Linfadenopatía
- Aumento del ritmo cardíaco
- dolores de cabeza
- Trombosis cerebral
- Trombosis del seno venoso cerebral
- Trombosis venosa cerebral
- Trombosis venosa profunda
- Trombosis de la vena mesentérica
- Trombosis de la vena porta
- Trombosis del seno sagital superior
- herpes zóster
- Trombosis
- Trombosis venosa
- Miembro de trombosis venosa
- tinnitus
- muerte súbita
- sangrado intermenstrual
- Menstruación retrasada
- menstruación irregular
- Urticaria
La siguiente sección ya no se actualizará. ¡El desarrollo de los datos de la EMA será reemplazado por los vídeos de arriba!
Actualización de datos – EMA – VAERS – OMS – Informes de efectos secundarios
* aumentar del 13 de noviembre de 2021 al 3 de diciembre de 2021 en 368.653 Mensajes
Informes totales: EMA 1.254.029 (+ 90.673*) / OMS 2.706.410 (+206.529*) / CDC/FDA 951857 (+71,451*)
Síntoma: Parálisis de Bell (parálisis facial) - Informes registrados
Incremento del 30 de diciembre de 2021 al 15 de enero de 2022 / 17 de diciembre de 2021 al 7 de enero de 2022 6.620 casos
Fuentes: adrreports.eu (EMA) / vigiaccess.org (OMS) – A partir del 10 de diciembre de 2021
Fuente: vaers.hhs.gov (CDC/FDA) – a partir del 3 de diciembre de 2021
EMA
6.113 (+ 1.350*)
OMS
7.875 (+ 3.650*)
VAERS
5.405 (+ 1.620*)
Síntoma: Trastornos menstruales – Informes registrados
Fuentes: adrreports.eu (EMA) / vigiaccess.org (OMS) – A partir del 13 de noviembre de 2021
Fuente: vaers.hhs.gov (CDC/FDA) – A partir del 5 de noviembre de 2021
EMA
9.849
OMS
15.660
VAERS
4.002
Síntoma: Aborto espontáneo – Informes registrados
Fuentes: adrreports.eu (EMA) / vigiaccess.org (OMS) – A partir del 13 de noviembre de 2021
Fuente: vaers.hhs.gov (CDC/FDA) – A partir del 5 de noviembre de 2021
EMA
1.823
OMS
3.424
VAERS
2.188
Síntoma: Linfadenopatía – Informes Registrados
* aumentar del 18 de diciembre de 2021 - 24 de diciembre de 2021 / 10 de diciembre de 2021 - 17 de diciembre de 2021 en 713 casos
Fuentes: adrreports.eu (EMA) / vigiaccess.org (OMS) – A partir del 24 de diciembre de 2021
Fuente: vaers.hhs.gov (CDC/FDA) – A partir del 17 de diciembre de 2021
EMA
50.222
OMS
94.166
VAERS
31.040
Síntoma: Muertes – Informes registrados
datos actuales sobre Exceso de mortalidad en todos los grupos de edad se puede encontrar diariamente aquí.
Los gráficos se crean utilizando datos de 29 países participantes: Bélgica, Dinamarca, Estonia, Finlandia, Francia, Alemania, Alemania (Berlín), Alemania (Hesse), Grecia, Hungría, Irlanda, Israel, Italia, Luxemburgo, Malta, Países Bajos, Noruega. , Portugal, Eslovenia, España, Suecia, Suiza, Gran Bretaña (Inglaterra), Gran Bretaña (Irlanda del Norte), Gran Bretaña (Escocia), Gran Bretaña (Gales) y Ucrania.
Ucrania, Alemania (Berlín) y Alemania (Hesse) no se incluyeron en los datos agrupados.
(Fuente: Euromomo)
* aumentar del 16 de marzo de 2022 al 26 de marzo de 2022 / del 5 de marzo de 2022 al 18 de marzo de 2022 en 2.595 Fallecidos
(duplicando a partir del 15 de marzo/4 de marzo)
Fuentes: adrreports.eu (EMA) – a partir del 26 de marzo de 2022 / vigiaccess.org (OMS) – A partir del 26 de marzo de 2022
Fuente: vaers.hhs.gov (CDC/FDA) – A partir del 18 de marzo de 2022
EMA
23.157 (+609*)
OMS
19.088 (+736*)
VAERS
25.051 (+1.250*)
Síntoma: Miocarditis (inflamación del músculo cardíaco) – Informes registrados
* aumentar del 19 de noviembre de 2021 al 3 de diciembre de 2021 / del 12 de noviembre de 2021 al 29 de noviembre de 2021 en 2.088 Mensajes
Fuentes: adrreports.eu (EMA) / vigiaccess.org (OMS) – A partir del 19 de noviembre de 2021
Fuente: vaers.hhs.gov (CDC/FDA) – A partir del 12 de noviembre de 2021
EMA
8.292 (+1.028*)
OMS
13.371 (+1.235*)
VAERS
7.879 (+693*)
Síntoma: Pericarditis (inflamación del saco cardíaco) – Informes registrados
* aumentar del 10 de diciembre de 2021 al 24 de diciembre de 2021 en 10.367 Mensajes
Fuentes: adrreports.eu (EMA) / vigiaccess.org (OMS) – A partir del 24 de diciembre de 2021
Fuente: vaers.hhs.gov (CDC/FDA) – A partir del 17 de diciembre de 2021
EMA
9.932 (+3.205*)
OMS
16.234 (+5.306*)
VAERS
9.546 (+4.033*)
Síntoma: Herpes Zoster – Informes registrados
Fuentes: adrreports.eu (EMA) / vigiaccess.org (OMS) – A partir del 13 de noviembre de 2021
Fuente: vaers.hhs.gov (CDC/FDA) – A partir del 5 de noviembre de 2021
EMA
12.876
OMS
23.682
VAERS
9971
Síntoma: Trombosis – Informes registrados
Fuentes: adrreports.eu (EMA) / vigiaccess.org (OMS) – A partir del 13 de noviembre de 2021
Fuente: vaers.hhs.gov (CDC/FDA) – A partir del 5 de noviembre de 2021
EMA
8.110
OMS
11.254
VAERS
6.284
Síntoma: Muerte Súbita – Informes Registrados
Fuentes: adrreports.eu (EMA) / vigiaccess.org (OMS) – A partir del 13 de noviembre de 2021
Fuente: vaers.hhs.gov (CDC/FDA) – A partir del 5 de noviembre de 2021
EMA
829
OMS
1.463
VAERS
729
Evaluación de la idoneidad de la técnica RT-qPCR para
Evidencia de posible infección y
Infectividad de los individuos respecto al SARS-CoV-2
Informe actual del Dr. rer. biol. tararear. Ulrike Kämmerer
El informe es aquí del sitio web el Médicos y Científicos por la Salud, la Libertad y la Democracia, eV o almacenado aquí descargable.
Resultados falsos positivos de la prueba PCR en el banco de pruebas
Los investigadores Leslie C. Woodcock, P. Stallinga e Igor Khmelinskii de la Universidad Portuguesa del Algarve informan en su artículo publicado en The Lancet Respiratory Medicine en noviembre de 2021. Papel de los exosomas en las pruebas de PCR de covid-19 falsamente positivas sobre los resultados de sus investigaciones, que tratan sobre esto enlace están disponibles para descargar.
Actualización de datos – EMA – VAERS – OMS – Informes de efectos secundarios
Los investigadores Leslie C. Woodcock, P. Stallinga e Igor Khmelinskii de la Universidad Portuguesa del Algarve informan en su artículo publicado en The Lancet Respiratory Medicine en noviembre de 2021. Papel de los exosomas en las pruebas de PCR de covid-19 falsamente positivas sobre los resultados de sus investigaciones, que tratan sobre esto enlace están disponibles para descargar.
Comparación de los efectos secundarios notificados de las vacunas en 1.000 casos

Restricción de derechos fundamentales
En el Boletín Oficial Federal Parte I 2021 No. 83 del 11 de diciembre de 2021 Ley para fortalecer la
Prevención de vacunación contra Covid-19 y cambios a otras regulaciones en relación con la pandemia de Covid a partir del 10 de diciembre de 2021 convertirse en derechos fundamentales
- integridad física
- la libertad de la persona
- libertad de reunión
- de libertad de movimiento
- la inviolabilidad del apartamento
RESTRINGIDO (descargar PDF):

Los siguientes cambios entrarán en vigor el 25 de noviembre de 2021:
Artículo 16 – Modificación del Libro Duodécimo del Código Social “Artículo 142 Reglamento transitorio para el almuerzo comunitario para personas con discapacidad debido a la pandemia de Covid-19; Autorización para dictar reglamentos.”
Artículo 17 – Modificación de la Ley Federal de Abastecimiento
Artículo 18 – Enmienda a la Ley de Solicitantes de Asilo
Los siguientes cambios entrarán en vigor el 1 de enero de 2022:
Artículo 12a – Modificación del Libro Tercero del Código Social
“En el artículo 109, apartado 5, frase 3, la declaración “31. Diciembre de 2021” reemplazado por “31 de marzo de 2022”.
“El artículo 421c se modifica como sigue: “aa) En la oración anterior al número 1, se reemplazan las palabras “hasta el 31 de diciembre de 2021” por las palabras “del 1 de enero de 2022 al 31 de marzo de 2022”. bb) En la frase posterior al número 2, se suprimen las palabras “si el derecho a las prestaciones por jornada reducida surgió antes del 31 de marzo de 2021 y””.
Los siguientes cambios entrarán en vigor el 1 de enero de 2023:
Artículo 2 – Nuevos cambios a la Ley de Protección contra Infecciones
“La Ley de Protección contra Infecciones, modificada por última vez por el artículo 1 de esta Ley, queda modificada como sigue:
- El §§ 20a y 20b quedan derogados.
- § 73 se modifica de la siguiente manera:
a) Se deroga el apartado 1a números 7e a 7h
b) En el apartado 2, se sustituye la información “7h” por la información “7d”.
Entrevista vacunación corona obligatoria: pros y contras – MDR
Martes 23 de noviembre de 2021 6:50 a.m. - Duración 6:50 min.
El Entrevista por MDR se reproduce a continuación como transcripción y aquí como Descarga de audio disponible. El moderador es Tim Deisinger, sus interlocutores son el Prof. Peter Dabrock, Profesor de Teología de la Universidad de Erlangen Nuremberg y el Dr. medicina Steffen Rabe, pediatra en Múnich y miembro de la junta directiva del Médicos para decisiones individuales de vacunación e. v. (ÄIIE).
- Moderador, Tim Deisinger:
El gran tabú de que la vacunación general obligatoria ya no existe, muchos se pronuncian y lo apoyan. Queremos verlo más de cerca esta mañana y también queremos saber su opinión al respecto, hablaremos más sobre eso en un momento. En primer lugar, una especie de base para el debate, por así decirlo. Queremos escuchar dos puntos de vista.
El segundo será entonces pediatra. El primero es ahora Peter Dabrock, profesor de teología en la Universidad de Erlangen en Núremberg y presidente del Consejo de Ética Alemán hasta 2020. Sr. Dabrock, ¿cómo ve eso? Vacunación general obligatoria, ¿sí o no?
- Prof. Peter Dabrock:
Entonces, admito que en lo que respecta a la vacunación obligatoria general, mi posición ha cambiado con el tiempo y eso es lo que notamos también en estas preguntas: no hay un solo juicio que hayas hecho una vez y luego te atengas a él. pero hay que adaptarlo a las circunstancias. He estado promoviendo esto durante meses y también esperaba que la gente se diera cuenta de que existe un riesgo mínimo para usted y un gran beneficio para usted y para los demás.
y que por tanto se vacunen por autoprotección, protección directa de los demás y solidaridad. No fue así y cuando me enteré de que se había vuelto muy rígido, hace tres semanas se hizo una encuesta correspondiente. Mi posición también ha cambiado y por eso ahora me inclino por decir que necesitamos requisitos generales de vacunación y lo más rápido posible.
- Moderador, Tim Deisinger:
Pero comprensión para aquellos que no quieren vacunarse o no quieren vacunarse todavía, ¿todavía tienen eso?
- Prof. Peter Dabrock:
Entonces, por supuesto, uno piensa en ello, especialmente cuando siente una resistencia tan grande a caminar, y luego siempre escucha dos argumentos: en realidad es proporcionado y no es
una invasión de la integridad física. Los dos también están relacionados y yo diría, en primer lugar, que en lo que respecta a la integridad física, cualquiera que esté en contra de la vacunación obligatoria debe tener claro que el daño al cuerpo si uno sufre la enfermedad o incluso si otros que la padecen serán enormemente más grande. Toda la ciencia seria dice que claramente existen riesgos residuales mínimos, pero los beneficios son significativamente mayores.
La otra cosa es que nunca se puede hacer que la integridad física sea absoluta cuando se trata de derechos básicos, sino que hay que ponerla en concordancia práctica con otros derechos básicos y si la libertad de todos los demás se restringe masivamente porque, Un pequeño grupo asegura que, eh, que si el virus continúa propagándose así, entonces la integridad física, que puedo entender a primera vista, no puede ser absoluta.
- Moderador, Tim Deisinger:
La opinión de Peter Dabok, ex presidenta del Consejo Ético Alemán. Y ahora queremos escuchar al doctor Steffen Raabe, pediatra y médico adolescente, portavoz de la junta directiva de la Asociación de Médicos para las Decisiones Individuales de Vacunación, Sr. Rabe, por lo que su línea de pensamiento ya está indicada en el nombre de la asociación. ¿Todavía puedes entender el argumento del Sr. Darbrock?
- Dr. Steffen Rabé
No, el argumento a favor de la vacunación obligatoria me resulta completamente incomprensible, especialmente en el caso de las vacunas contra el Covid. Y cuando escuché al Sr. Darbrock y discutió con la protección indirecta de terceros, ese fue, por supuesto, el punto crucial. Sólo tal argumento puede siquiera justificar la consideración de la vacunación obligatoria y es precisamente este aspecto el que las vacunas contra el Covid no cubren. Las vacunas Covid brindan a quienes desean protegerse una protección temporal, no mala, contra enfermedades graves. Pero no tienes ninguna protección relevante de terceros.
Esto significa que cualquier argumento a favor de la vacunación obligatoria está fuera de discusión. Y si habla de un riesgo bajo y mínimo con la vacunación, entonces está simplemente equivocado. Como pediatra, me encuentro sentado frente a jóvenes de 16 y 18 años a quienes tengo que decirles que si ahora se vacunan con Biontech, la única vacuna recomendada y aprobada para ellos en este momento, entonces estarán en Riesgo La incidencia de miocarditis como resultado directo de esta vacunación es de al menos 1:5000. Sr. Deisinger, no conocemos ningún otro medicamento. No conozco ninguna otra vacuna desde hace 30 años que combine una enfermedad tan grave como la miocarditis con un riesgo tan dramáticamente alto. Esta vacunación obligatoria no es en modo alguno inteligente desde el punto de vista jurídico, moral o médico; más bien, como bien dijo el Sr. Hans-Jürgen Pape, es una expresión de impotencia y de impotencia;
- Moderador, Tim Deisinger:
Entonces tomemos la impotencia cuando miramos la situación en las unidades de cuidados intensivos o en los hospitales en general, que se presenta como un argumento más de que hay una emergencia y no hay otra salida a la emergencia que exigir la vacunación.
- Dr. Steffen Rabé
Pero, señor Deisinger, la vacunación obligatoria no es una medida inmediata. Nos mentimos a nosotros mismos en cuanto a la preparación jurídica, la implementación política y la eficacia médica si vemos algún efecto en las unidades de cuidados intensivos dentro de dos o tres semanas. Tenemos que dejar de reducir el número de unidades de cuidados intensivos y de camas de cuidados intensivos. En lugar de obligarlas a abandonar la profesión con vacunas obligatorias, por fin debemos mostrar a las enfermeras allí el aprecio que necesitan para que puedan permanecer en su profesión. Y la política fracasó completamente durante dos años. Esta catástrofe es una catástrofe con anuncio, señor Deisinger. Sabíamos que este otoño sería otro desafío, también para los hospitales y las unidades de cuidados intensivos, y rápidamente desmantelamos miles de camas de cuidados intensivos. Y eso debería servir ahora como argumento para una intervención en uno de los derechos fundamentales centrales, y aquí contradigo vehementemente al señor Dabrock, el derecho a la integridad física, especialmente en un país como Alemania, que tiene este pasado desafortunado, incluso en el En el campo médico con estas intervenciones debemos ser muy, muy cuidadosos y muy, muy cuidadosos con este pensamiento.
Excipientes ALC-0315 y ALC-0159 “solo para fines de investigación”
Los excipientes contenidos en Pfizer/BioNTech Comirnaty ALC-0315 [(4-hidroxibutil)azanediil]di(hexano-6,1-diil)bis(2-hexildecanoato) (CAS 2036272-55-4) y ALC-0159 2-[(polietilenglicol)-2000]-N,N-ditetradecilacetamida (CAS 1849616-42-7) es según el fabricante Biociencias ABP destinado únicamente para uso en investigación.
Estudios actualmente disponibles sobre estos excipientes:
- http://www.eurannallergyimm.com/cont/journals-articles/1043/volume-potential-culprits-immediate-hypersensitivity-reactions-4579allasp1.pdf (PDF)Descargar) 29.04.2021
- https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(21)00064-2?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1525001621000642%3Fshowall%3Dtrue (PDF)Descargar) 04.02.2021
Sitio web del gobierno federal – eliminación de la afirmación “¿Habrá obligación legal de vacunar? NO”
La versión fechada 17.11.2021 00:39:55 todavía estaba

La versión fechada 19.11.2021 16:44:31 es ahora (aquí disponible en el original):

Los enlaces anteriores son a través de WayBackMachine (https://web.archive.org) páginas de archivo seguras.
Lo que llama la atención es que “las vacunas siguen siendo monitoreadas y probadas incluso después de haber sido aprobadas…”. Las “aprobaciones” son solo aprobaciones –condicionales– y deben renovarse anualmente hasta la aprobación final (ver más abajo).
Prórroga de las aprobaciones –condicionales– de las vacunas Covid-19
Los documentos respectivos mencionados a continuación y disponibles para su descarga se pueden encontrar en la sección “Procedimientos de la Comisión Europea“ a través del enlace respectivo que figura aquí “Decisión de Ejecución de la Comisión” en forma de archivo ZIP haciendo clic en el respectivo Icono de documento se puede descargar en la columna de la derecha.
El primer símbolo significa "Decisiones"(El archivo ZIP comienza con "Dic", el segundo para "Anexidades", correspondiente "anx". El final del nombre del archivo de los archivos descomprimidos representa la abreviatura del idioma (de – alemán)
En la (segunda) columna “Tipo de procedimiento“, por ejemplo, hay entradas sobre “Actualizaciones mensuales“ (Actualizaciones de información del fabricante sobre el producto, efectos secundarios, etc.) “Corrección“ (correcciones de traducción), “Decisión rectificativa“ (decisiones sobre protección de comercialización, prórrogas de la misma), así como “Renovación anual“(Prórroga de la aprobación condicional).
Comirnaty – BionTech/Pfizer
La Comisión Europea en Bruselas anunció el documento el 3 de noviembre de 2021. C(2021) 7992 (final), dem Decisión de ejecución de la Comisión a partir del 3 de noviembre de 2021, “sobre la prórroga anual de la autorización condicional del medicamento humano “Comirnaty – Tozinameran, vacuna de ARNm contra la COVID-19 (nucleósido modificado)” concedida por la Decisión C(2020) 9598(final) y por la que se modifica dicha decisión", con: "Se prorroga la autorización condicional otorgada mediante Decisión C(2020) 9598(final) de 21 de diciembre de 2020.“
Spikevax – Moderna
La Comisión Europea en Bruselas compartirá el documento el 4 de octubre de 2021 C(2021) 7305 (final), dem Decisión de ejecución de la Comisión a partir del 4 de octubre de 2021, “sobre la prórroga anual de la autorización condicional del medicamento humano “Spikevax – vacuna de ARNm contra la COVID-19 (modificada con nucleósidos)” concedida por la Decisión C(2020) 94(final) y por la que se modifica dicha decisión", con: "Se prorroga la autorización condicional otorgada por la Decisión C(2021) 94(final) de 6 de enero de 2021.“
Vaxzevira – AstraZeneca
La Comisión Europea en Bruselas anunció el documento el 9 de noviembre de 2021. C(2021) 8206 (final), dem Decisión de ejecución de la Comisión a partir del 9 de noviembre de 2021, “sobre la prórroga anual de la autorización condicional del medicamento humano “Vaxzevira - Vacuna de ARNm contra la COVID-19 (modificada con nucleósidos)” concedida por la Decisión C(2020) 698(final) y por la que se modifica dicha decisión", con: "Se prorroga la autorización condicional otorgada mediante Decisión C(2021) 698(final) de 29 de enero de 2021.“
Vacuna Covid-19 – Janssen
Actualmente mientecon el documento C(2021) 1763 (final) solo eso Decisión de ejecución de la Comisión para la aprobación condicional de la vacuna a partir del 11 de marzo de 2021.
En Artículo 4 dice: “El período de validez de la aprobación es de un año a partir de la fecha de publicación de esta decisión”.
Definiciones del Instituto Paul Ehrlich (PEI) sobre las vacunas contra el COVID-19
Los enlaces a la versión del 15 de agosto de 2021 y del 7 de septiembre de 2021 están disponibles a través de WayBackMachine (https://web.archive.org) páginas de archivo seguras, mientras que la versión actual del 23 de septiembre de 2021 * a través del enlace al pagina original del PEI se puede leer. También están las cartas de Mano Roja emitidas por las farmacéuticas. aquí disponible para descargar.
Todos los sitios web enumerados están disponibles aquí como descarga en PDF.
15/08/2021 – “Las vacunas COVID-19 protegen contra las infecciones por el virus SARS-CoV-2.” (sitio web como descargar PDF)
07/09/2021 – “Las vacunas COVID-19 protegen contra infecciones graves por el virus SARS-CoV-2.“ (Sitio web como descargar PDF)
23 de septiembre de 2021 * – “Las vacunas contra el COVID-19 están indicadas como inmunización activa para prevenir la enfermedad COVID-19 causada por el virus SARS-CoV-2.“ (Sitio web como descargar PDF)
Nuestro mundo en datos: Covid-19, vacunas, muertes
en el sitio web Nuestro mundo en datos La Universidad John Hopkins proporciona datos recopilados oficialmente sobre diversos temas en todo el mundo, incluidas las siguientes estadísticas para Alemania:
Enlace a estadísticas – Proporción de personas que recibieron al menos una dosis de la vacuna COVID-19
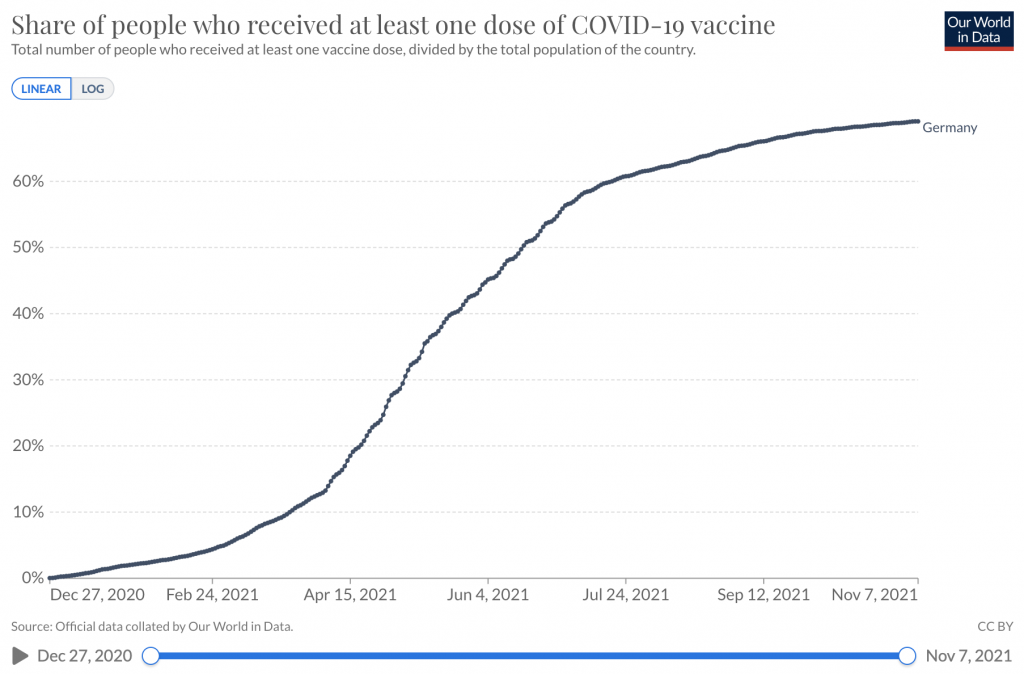
Enlace a estadísticas – Casos acumulados confirmados de COVID-19 por millón de personas
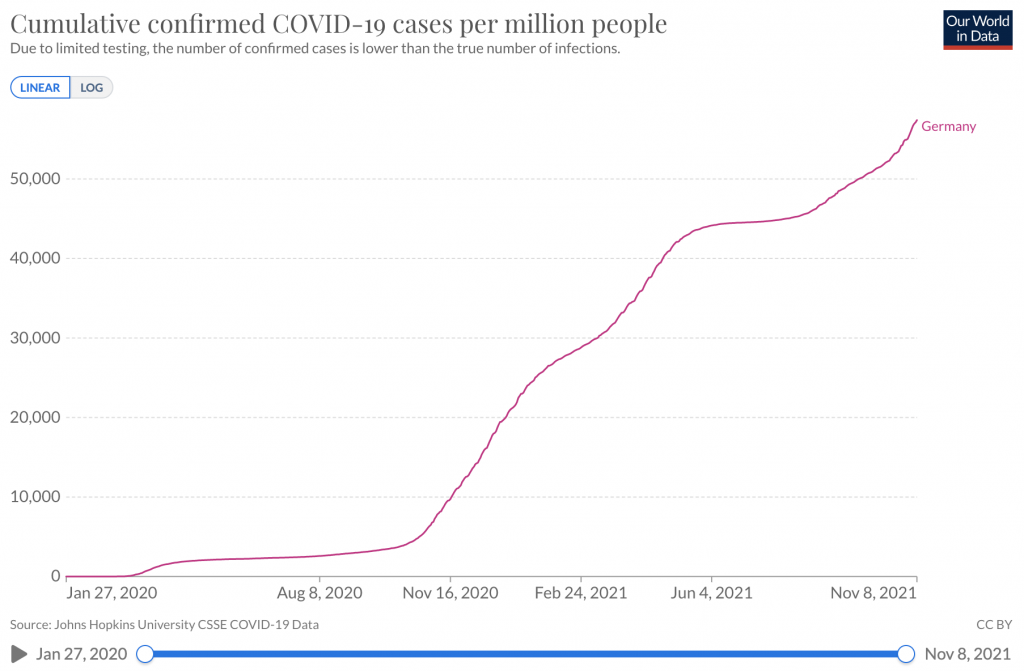
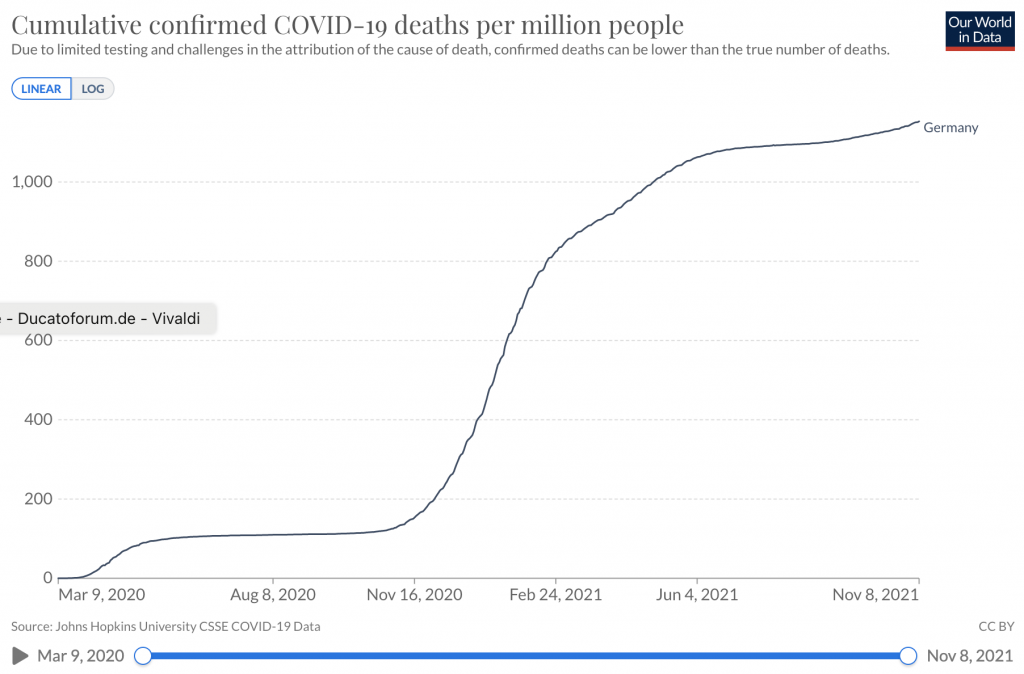
Enlace a estadísticas – Muertes acumuladas por COVID-19 por millón de personas
Consejo de Europa – Resolución 2361/2021
El Consejo de Europa tiene en su resolución titulada Vacunas Covid-19: consideraciones éticas, legales y prácticas Se han elaborado recomendaciones que abordan, entre otras cosas, la distribución justa de las vacunas, el carácter voluntario de la vacunación y la no discriminación contra las personas que, por cualquier motivo, optan por no vacunarse.
“7.3.1. garantizar que los ciudadanos estén informados de que la vacunación no es obligatoria
y que nadie sea sometido a presiones políticas, sociales o de otro tipo para vacunarse
si él no quiere hacerlo él mismo."
“7.3.2 garantizar que nadie sea discriminado por no haber sido vacunado, por posibles riesgos para la salud o por no querer vacunarse”.
Dado que el Consejo de Europa no tiene poderes legislativos, estas recomendaciones no son legalmente vinculantes para ninguno de los estados miembros.
De estas recomendaciones no se puede derivar ni una prohibición de la vacunación obligatoria ni una discriminación, aunque esto sería deseable en interés de los ciudadanos responsables...
virus de marburgo
Desde principios de 2021 se publican cada vez más artículos sobre el virus de Marburgo. Uno apareció el 25 de febrero de 2021. publicación de Elsevier Inc. en Biblioteca Nacional de Medicina.
Casi dos meses después, el 22 de abril de 2021, fue el titular GAVI La Alianza para las Vacunas „La próxima pandemia: ¿Marburgo?“
Ya en 2018 el Primer diseño Ltd. una prueba PCR”Kit estándar de genes de proteína viral 35 (VP35) Marburgvirus genesig„.
Aunque el virus de Marburg, por primera vez descrito en 1967Como era pariente del virus del Ébola, las 376 muertes en ese momento y sólo 16 desde 2005 son muy limitadas.
En este contexto, parece incomprensible el excesivo impulso en el desarrollo de la vacuna contra el virus de Marburgo. RiVax® a través de Soligenix Inc.. La prisa por proceder según las directrices de experimentación con animales de la FDA, evitando las habituales fases de prueba 1, 2 y 3, es motivo de reflexión.
El 22 de septiembre de 2021, Kieran Morrissey, Dublín, Irlanda, resumirá sus pensamientos sobre este tema. aquí juntos.
Opinión jurídica sobre la vacunación obligatoria indirecta
En un documento de 111 páginas. Opinión jurídica A partir del 4 de octubre de 2021 Prof. Dr. Dietrich Murswiek, sopesando todos los aspectos a tener en cuenta, llegó a la conclusión sumaria: “La discriminación de los no vacunados en el marco de las normas de acceso a la vida pública y en el marco de las normas de cuarentena viola los derechos fundamentales de aquellos afectado y es inconstitucional”.
Artículo_Li
Los hospitales deberían contratar, no despedir, enfermeras con inmunidad natural
POR MARTIN KULLDORFF 1 DE OCTUBRE DE 2021 HISTORIA, POLÍTICA, SALUD PÚBLICA, SOCIEDAD 4 MINUTOS
Entre muchos acontecimientos sorprendentes durante esta pandemia, el más sorprendente ha sido el cuestionamiento de la inmunidad adquirida naturalmente después de que una persona ha padecido la enfermedad de Covid.
Hemos entendido la inmunidad natural desde al menos el Plaga ateniense en 430 a.C. Aquí está Tucídides:
'Sin embargo, fue con aquellos que se habían recuperado de la enfermedad que los enfermos y los moribundos encontraron mayor compasión. Éstos sabían lo que era por experiencia y no temían por sí mismos; porque el mismo hombre nunca fue atacado dos veces, al menos nunca fatalmente. – Tucídides
Hemos vivido con coronavirus endémicos durante al menos cien años, frente a los cuales tenemos una inmunidad natural duradera. Como era de esperar, también tenemos inmunidad natural después de la enfermedad Covid-19, ya que ha habido muy pocas reinfecciones con enfermedad grave o muerte, a pesar de que el virus circula ampliamente.
Para la mayoría de los virus, la inmunidad natural es mejor que la inmunidad inducida por vacunas, y eso también se aplica al Covid. En el mejor estudio hasta la fecha, los vacunados tenían alrededor de 27 veces más probabilidades de tener enfermedades sintomáticas que aquellos con inmunidad natural, con un rango estimado entre 13 y 57. Sin muertes por Covid en ninguno de los grupos, tanto la inmunidad natural como la vacuna protegen bien contra la muerte.
Durante la última década he trabajado estrechamente con epidemiólogos de hospitales. Si bien el papel de los médicos es tratar a los pacientes y mejorarlos, la tarea del epidemiólogo del hospital es garantizar que los pacientes no se enfermen mientras están en el hospital, como por ejemplo contraer un virus mortal de otro paciente o de un cuidador.
Para ello, los hospitales emplean una variedad de medidas, desde lavarse las manos con frecuencia hasta insignias de control de infecciones cuando se atiende a un paciente con Ébola. Las vacunas son un componente clave de estos esfuerzos de control. Por ejemplo, dos semanas antes de la cirugía de bazo, a los pacientes se les administra la vacuna neumocócica para minimizar las infecciones postoperatorias, y la mayoría del personal clínico se vacuna contra la influenza todos los años.
Las medidas de control de infecciones son especialmente críticas para los pacientes mayores, frágiles y con un sistema inmunológico debilitado. Pueden infectarse y morir a causa de un virus al que la mayoría de las personas sobreviviría fácilmente. Una razón clave para inmunizar a enfermeras y médicos contra la influenza es garantizar que no infecten a dichos pacientes.
¿Cómo pueden los hospitales proteger mejor a sus pacientes de la enfermedad de Covid? Es una cuestión de enorme importancia, relevante también para las residencias de ancianos. Existen algunas soluciones estándar obvias, como separar a los pacientes de Covid de otros pacientes, minimizar la rotación del personal y ofrecer generosas bajas por enfermedad al personal con síntomas similares a los de Covid.
Otro objetivo debería ser contratar personal con la mayor inmunidad posible contra el Covid, ya que es menos probable que lo contraigan y lo transmitan a sus pacientes. Esto significa que los hospitales y residencias de ancianos deberían buscar activamente contratar personal que tenga inmunidad natural contra la enfermedad Covid anterior y utilizar dicho personal para sus pacientes más vulnerables.
Por lo tanto, ahora estamos viendo una competencia feroz en la que hospitales y hogares de ancianos intentan desesperadamente contratar personas con inmunidad natural. Bien, de hecho, no.
En cambio, los hospitales están despidiendo a enfermeras y otro personal con inmunidad natural superior, mientras retienen a aquellos con inmunidad inducida por vacunas más débil. Al hacerlo, están traicionando a sus pacientes, aumentando su riesgo de infecciones adquiridas en el hospital.
Al impulsar los mandatos de vacunas, el asesor médico jefe de la Casa Blanca, el Dr. Anthony Fauci cuestiona la existencia de inmunidad natural después de la enfermedad de Covid. Al hacerlo, sigue el ejemplo de la directora de los CDC, Rochelle Walensky, quien cuestionó la inmunidad natural en un informe de 2020. memorándum publicado por el Lanceta. Al establecer mandatos de vacunación, los hospitales universitarios ahora también cuestionan la existencia de inmunidad natural después de la enfermedad de Covid.
Esto es asombroso.
Trabajo en el Brigham and Women's Hospital de Boston, que ha anunciado que todas las enfermeras, médicos y otros proveedores de atención médica serán despedidos si no reciben la vacuna Covid. La semana pasada hablé con una de nuestras enfermeras. Trabajó duro cuidando a los pacientes de Covid, incluso cuando algunos de sus colegas se marcharon por miedo al comienzo de la pandemia.
Como era de esperar, se infectó, pero luego se recuperó. Ahora tiene una inmunidad más fuerte y duradera que los administradores de hospitales vacunados que trabajan desde casa y que la están despidiendo por no estar vacunada.
Si los hospitales universitarios no pueden obtener la evidencia médica correcta sobre la ciencia básica de la inmunidad, ¿cómo podemos confiarles otros aspectos de nuestra salud?
¿Qué sigue? ¿Las universidades se preguntan si la Tierra es redonda o plana? Eso, al menos, haría menos daño.

Martín Kulldorff, académico senior del Instituto Brownstone, es profesor de medicina en la Facultad de Medicina de Harvard
kulldorff@brownstone.org
Denuncia penal y denuncia penal en el complejo BioNTech
Al Fiscal General Federal del Tribunal Federal de Justicia Dr. Pedro Frank
El 10 de junio de 2021, el abogado Tobias Ulbrich del bufete de abogados Robert & Ulbrich, Otto Str. 12, 50859 Colonia, arriba, presentó una denuncia penal contra “todas las personas que desarrollaron la sustancia experimental de ARNm de BioNTech/Pfizer conocida como ' La vacuna' la fabricó, la distribuyó, la aprobó para la vacunación y la administró a gente ignorante. En particular contra:
1. Alexandra Knauer, Director general de la empresa Knauer Wissenschaftliche Geräte GmbH, Hegauer Weg 38, 14163 Berlín (fabricante de máquinas para la producción de nanopartículas lipídicas)
2. Vasant Nasasimhan, CEO de Novartis AG, (titular de la patente de nanopartículas lipídicas AC – 0135 y AC 0159)
3. James Bradner, MD Presidente de los Institutos Novartis de Investigación Biomédica (NIBR), desarrollador de los lípidos
4. Thomas D. Madden Ph.D. CEO Acuitas Therapeutics, fabricante de lípidos para Biontech 5. Ying K. Tam, Director científico de Acuitas Therapeutics,
6. Sean Semple, Director Senior de Investigación Pre – Clínica
7. Dra. Dietmar Katinger, director general Donaustraße 99, 3400 Klosterneuburg, Austria (fabricante y desarrollador de producción en Biontech SE)
8. Prof. Dr. Ugur Sahin, director ejecutivo de BioNTech SE, En Goldgrube 12, 55131 Maguncia
9. Sean Marett, CBO y CCO, BioNTech SE, ibídem
10. Dra. Sierk Poetting, director financiero y director de operaciones, BioNTech SE, ibídem
11. PD Dr. Özlem Türeci, director de marketing de BioNTech SE, ibídem
12. Ryan Richardson, director de operaciones de BioNTech SE, ibídem
13. Karin Samusch, Dermapharm AG, Lil-Dagover-Ring 7, 82031 Grünwald (Productor)
14. Hilde Neumeyer, Dermapharm AG, Lil-Dagover-Ring 7, 82031 Grünwald (Productor) 15. Dra. Hans-Georg Feldmeier, Dermapharm AG, Lil-Dagover-Ring 7, 82031 Grünwald (Productor)
16. Dra. Jürgen Ott , Dermapharm AG, Lil-Dagover-Ring 7, 82031 Grünwald (productor) 17. Mark Pfister, Jefe de producción de Biontech en Novartis AG en Marburg (productor) 18. Dra. marca sabina, Siegfried Hameln, Langes Feld 13, 31789 Hameln, Alemania (Productor)
19. Dra. Sven Remmerbach, Baxter Oncology GmbH, Kantstraße 2, 33790 Halle/Westfalia (Productor)
20. Dra. Fabricio Guidi, Presidente; Sanofi-Aventis Deutschland GmbH, polígono industrial Höchst, K703, Brüningstr. 50, 65926 Fráncfort (productor)
21. Dra. Matías Braun, Sanofi-Aventis Deutschland GmbH
22. Oliver Coenenberg, Sanofi-Aventis Deutschland GmbH,
23. Evelyne viernes, Sanofi-Aventis Deutschland GmbH,
24. Prof. Dr. Jochen Maas, Sanofi-Aventis Deutschland GmbH,
25. Prof. Dr. cichutek, Presidente del Instituto Paul Ehrlich (incumplimiento de la obligación de vigilancia y advertencia, no retirada de la autorización)
26. Prof. Dr. vieths, Vicepresidente del Instituto Paul Ehrlich,
27. Dra. Keller-Stanislavski, Departamento de Seguridad de Medicamentos y Dispositivos Médicos del Instituto Paul Ehrlich.
28. Prof. Dr. Hilda, Jefe del Departamento de Virología del Instituto Paul Ehrlich
29. Prof. Dr. van Zandbergen, jefe del departamento de inmunología del Instituto Paul Ehrlich
30. Dr. Agregar, Jefe del Departamento 3 y 4, Vacunas Terapéuticas del Instituto Paul Ehrlich 31. Matías Groote, Representante de la EMA en el Parlamento Europeo, Bergmannstraße 37, 26789 Leer,
32. Karl Broich, Presidente del Instituto Federal de Medicamentos y Productos Sanitarios y representante de la EMA en Alemania, Kurt-Georg-Kiesinger-Alle 3, 53175 Bonn,
33. Sra. Emer Cooke, Presidente de la EMA, Domenico Scarlattilaaan 6, 1083 HS Amsterdam,
34. El ministro federal de Sanidad, Jens Spahn, Rochusstraße 1, 53123 Bonn,
35. Profesor Dr. Lothar H. Wieler, para descargar a través del Instituto Robert Koch,
36. Profesor Dr. Christian Drosten, para descargar a través del Instituto Robert Koch,
37. Bill y Melinda Gates,
et al
Además, en los centros de vacunación se encuentran todos los vacunadores que administraron la 'vacuna' sin hacer referencia al estado de aprobación ni a las consecuencias de la vacunación, que el firmante desconoce.
Por genocidio, intento de genocidio, violación del artículo 20 de la KrWKG y alta traición contra el gobierno federal, entre otros„
El muy interesante texto completo (194 páginas) es aquí disponible y cita, entre otros, al historiador Dr. Paul Schreyer, quien “resumió los acontecimientos de los últimos 20 años y presentó la influencia de las ONG (Organizaciones No Gubernamentales) en la preparación de la pandemia”.
LUBECAVAX – Prof. Dr. Winfried Stöcker, Lübeck
Al 31 de agosto de 2021
Winfried Stöcker nació en Alta Lusacia en 1947. Estudió medicina de 1967 a 1973 en Würzburg, se doctoró en 1976, profesor en la Universidad Médica Tongji de Wuhan desde 1999, profesor honorario en la Universidad de Lübeck desde 2011, fundó la empresa EUROIMMUN Laboratorio Médico Diagnóstico AG 1987 con especialización en diagnóstico autoinmune y de alergias, así como en serología de infecciones y genética molecular.
Profesor Dr. Stöcker comenzó a desarrollar una vacuna eficaz contra el SARS CoV2 desde el principio: primero la probó él mismo, luego vacunó a sus familiares y finalmente puso la vacuna de fabricación propia a disposición de sus empleados.
Él describe cómo funciona en su Blog de la siguiente manera (Cita):
Suponemos que una infección por corona se puede prevenir eficazmente mediante una vacuna. El Vacunación en Lübeck utiliza un pequeño antígeno trivial, diseñado a medida y genéticamente, que el cuerpo no tiene que sintetizar por sí mismo, como es el caso de los procesos basados en transferencia de genes. Induce la formación de anticuerpos en el organismo del receptor exactamente contra aquellas estructuras del virus con las que se une a los receptores de angiotensina-2 de las células endoteliales en personas no vacunadas. Mediante este bloqueo, los anticuerpos evitan que las células se infecten y el virus no pueda encontrar un punto de apoyo.
Las vacunas se suelen realizar tres veces: el día cero, luego aproximadamente 14 días y nuevamente después de aproximadamente otras cuatro semanas. La concentración de anticuerpos se mide 14 días después, porque no tenemos la confianza oficialmente prescrita de que para entonces se habrá desarrollado la protección inmunitaria. Más del 95% de los pacientes finalmente muestran una alta concentración de anticuerpos de la clase de inmunoglobulina IgG contra las proteínas corona-spike, lo que significa que probablemente sean inmunes al corona. Las personas inmunocomprometidas son vacunadas una o dos veces con una dosis doble (esto sólo puede reconocerse examinando el suero) y la mitad de ellas alcanza entonces títulos elevados. Además, las mediciones mostraron que los anticuerpos podían neutralizar (inactivar) los virus corona y que en tres cuartas partes de los casos se desarrolló inmunidad de células T.
También informa sobre el tema de la producción y aplicación de vacunas por parte de los médicos en general (Cita):
En Alemania, todo médico puede mezclar un antígeno con un adyuvante (solo que ahora es una vacuna) e inyectarlo o aplicarlo legalmente individualmente a su paciente. El adyuvante retiene el antígeno y lo presenta al sistema inmunológico. Sin Adiuvans, el antígeno se distribuiría por todo el organismo y, por tanto, se diluiría hasta el punto de resultar ineficaz. Por razones funcionales, los dos componentes deben mantenerse separados y recién mezclados. Sin embargo, según la ley, el médico no puede transmitir a terceros la vacuna que ha producido (comercializarla).
La fuente aparece en su blog:
Medic GmbH
Jakob-Haringer-Straße 1
5020 Salzburgo
AUSTRIA
Correo electrónico: info@medidoc.uk
Número de teléfono: +43 59333 2000
medidoc.es
medidoc.us
medidorc.gmbh
UID: ATU33905904
Oficina de impuestos de la ciudad de Salzburgo 114/8583
Registro mercantil: 45971F
Tribunal de registro mercantil: Tribunal Regional de Salzburgo
El problema de que esta vacuna aún no está reconocida por la UE (en comparación con las aprobaciones de emergencia de preparados de ARNm y vectores) se compensa con el hecho de que se obtiene una inmunidad de células T similar a la de quienes se han recuperado.
La inmunidad de las células T se determina y certifica en laboratorios debidamente equipados. Este certificado sirve como prueba legalmente vinculante de inmunidad.
Mientras los que se han recuperado estén y permanezcan en pie de igualdad con los que han sido vacunados por el gobierno con respecto a diversas restricciones/relajaciones, esta vacuna es una alternativa, ahora bien probada, sin efectos secundarios comparables a los del ARNm. o preparaciones de vectores.
Vacuna BNT162b2: posible lectura errónea de codones, errores en la síntesis de proteínas y anomalías en el empalme alternativo
En uno científico comentario de fecha 25 de marzo de 2021, publicado como preimpresión por AUTHOREA, descargable como PDF en inglés, se destacan los posibles efectos secundarios de la vacuna BNT162b2 de BioNTec/Pfizer y se presenta el efecto general de las vacunas de ARNm. Aquí sigue la traducción al alemán:
Abstracto
La vacuna BNT162b2 contra el Covid-19 consta de un ARN de 4284 nucleótidos dividido en 6 secciones que proporcionan la información para crear una fábrica de proteínas S-spike que utiliza el Sars-CoV-2 (Covid-19) como huésped. Posteriormente, estas proteínas se dirigen fuera de la célula y desencadenan la respuesta inmune y la producción de anticuerpos.
El problema es la fuerte alteración del ARNm: se sustituye el uracilo para engañar al sistema inmunológico con Ψ (pseudouridina); las letras de todos los tripletes de codones se reemplazan por una C o una G para aumentar extremadamente la velocidad de síntesis de proteínas; Reemplazo de algunos aminoácidos con prolina; Añadiendo una secuencia (3′-UTR) con cambio desconocido.
Estas deficiencias podrían generar fuertes dudas sobre la presencia de errores en el uso de codones. Una posible traducción errónea tiene consecuencias para la fisiopatología de diversas enfermedades. Además, el ARNm inyectado es un pre-ARNm, que puede dar lugar a múltiples ARNm maduros; Se trata de anomalías en el empalme alternativo que representan una fuente directa de daños graves a largo plazo para la salud humana.
En esencia, lo que se genera puede no ser idéntico a la Proteína S Spike: simplemente un error en la decodificación traduccional, una mala lectura de los codones, la producción de diferentes aminoácidos y luego proteínas que causan graves daños a largo plazo a la salud humana, aunque el ADN no sea modificado, pero en el núcleo celular y no en el citoplasma, donde llega el ARNm modificado.
Sin embargo, en este caso, la correlación entre la tasa de síntesis y la expresión de proteínas con los errores de síntesis, así como el mecanismo que podría afectar la traducción de la secuencia, aún no está clara y muchos estudios aún no se han llevado a cabo.
introducción
Información sobre cómo funciona la vacuna.
La vacuna Sars-CoV-2 (Covid-19) de BioNTec/Pfizer, llamada BNT162b2, pero también llamada Tozinameran o Comirnaty, contiene alrededor de 30 µg de ARN que se inyecta en una esfera lipídica del cuerpo humano, concretamente en el citoplasma de las células, pero fuera del núcleo (donde se encuentra el ADN); este ARN tiene información genética modificada (de ahí modRNA), es decir, un ARNm (ARN mensajero) que contiene instrucciones para construir una fábrica de proteínas, clones de la proteína S Spike, es decir, la proteína (y solo la proteína, no todo el virus) de Covid -19 utilizado para invadir e infectar al huésped. Una vez producidos en serie por los ribosomas, se transportan fuera de la célula más allá de la capa lipídica; De esta forma, el sistema inmunológico identifica estas proteínas como células invasoras y las ataca produciendo anticuerpos. Por tanto, no es concebible que la vacuna induzca el Covid-19 o modifique el ADN humano.
Notas sobre la síntesis de proteínas.
La traducción generalmente se divide en tres fases: inicio, extensión y final.
- El ribosoma se une al ARNm en el codón de inicio;
- La cadena polipeptídica se alarga en una dirección del movimiento de los ribosomas mediante la adición sucesiva de aminoácidos;
- Cuando se encuentra un codón de parada, el polipéptido se libera y el ribosoma se disocia.
Errores en el ensamblaje y traducción de secuencias.
La conversión de la secuencia de ARNm en un polipéptido depende del ARN de transferencia (ARNt) para transportar aminoácidos al ribosoma. En los ribosomas, el ARNt se empareja con el ARNm mediante un emparejamiento de bases complementarias entre los nucleótidos codones del ARNm y los nucleótidos anticodones del ARNt. Una vez que el ARNt correcto está unido por un codón, transfiere su aminoácido al final de una cadena polipeptídica en crecimiento.
La decodificación de codones de ARNm mediante ARN de transferencia (ARNt) en el ribosoma implica el emparejamiento de bases de Watson-Crick.
Se estima que las tasas de error generales de la replicación genómica (aproximadamente 10-8) son aproximadamente 10.000 veces más bajas que las de la síntesis de proteínas (aproximadamente 10-4) y, por lo tanto, en la mayoría de los casos la traducción del ARNm es el proceso clave que conduce a la inexactitud de la proteoma celular. La discrepancia entre las tasas de error en la replicación del ADN y la traducción del ARNm puede deberse en parte al hecho de que la replicación del ADN ocurre a nivel de nucleótidos simples (con 41 = 4 permutaciones posibles), mientras que la maquinaria de traducción interpreta los codones del ARNm en tripletes (con 43 = 64 posibles permutaciones).(1)
La eficiencia de la maquinaria de decodificación de ARNm también está esencialmente regulada por el sesgo de uso de codones, que se caracteriza por codones sinónimos sobrerrepresentados o insuficientemente representados. En consecuencia, optimizar la oscilación del ARNt y el uso de codones en el ARNm puede mejorar significativamente la eficiencia y precisión de la traducción.(1)
La traducción previa o posterior al ARNm puede introducir indirectamente errores en la síntesis de proteínas durante la transcripción y el procesamiento postraduccional. Sin embargo, la maquinaria de traducción puede contribuir directamente a la traducción errónea mediante una decodificación errónea del ARNt (que conduce a una mala incorporación o lectura de codones de parada), una acilación errónea del ARNt (que conduce a un acoplamiento incorrecto de ARNt-aminoácido), una reasignación de codones o cambios de marco provocados por translocaciones ribosómicas.(1)
método de examen
Análisis de secuencia genética.
La vacuna consta de 4284 nucleótidos divididos en 6 secciones: cap es el inicio de la secuencia que comienza con los dos nucleótidos GA, lo que indica incorrectamente que el ARNm proviene de la célula humana y por lo tanto es aceptado; 5′ indica la dirección a seguir para la traducción, mientras que UTR indica la zona donde debe descansar el ribosoma para producir proteínas. En esta sección, la U de uracilo fue reemplazada por una molécula 1-metil-3′-pseudouridina, marcada con el signo Ψ, para evitar el sistema inmunológico y prevenir la degradación del ARNm recién invadido; Sin embargo, este es un factor que puede provocar errores en la producción de proteínas. Varias Ψ-sintasas participan en la modificación de posiciones específicas, y defectos en varias de ellas se han relacionado con enfermedades humanas (2).
Luego está la sección sig, denominada secuencia de inicio extendida del péptido señal de la glicoproteína S, cuya información es necesaria para guiar la proteína recién formada fuera de la célula a través del retículo endoplásmico; También aquí se modifican los tripletes de nucleótidos para que el ARN sea aceptado por el sistema inmunológico, unas letras que forman la información, otras (normalmente la tercera, "menearse"), aparentemente "sinónimos inofensivos" (principalmente aumentando la Número de letras C y G, que codifican la velocidad de síntesis de proteínas). Aunque especifican aminoácidos idénticos, los dos sinónimos no son exactamente iguales, al menos en lo que respecta a la traducción. Los estudios mecanicistas muestran que existen diferencias sutiles pero significativas en cómo cada uno interactúa con su correspondiente ARN de transferencia (ARNt), diferencias que afectan tanto la velocidad como la precisión de la traducción.3 Si bien es cierto que 3 letras por codón y más de un codón codifican mismo aminoácido, también es cierto que un aumento desproporcionado en la tasa de producción de proteínas podría suponer un riesgo de graves errores de traducción.
También los caracteres que componen la secuencia relacionada con la construcción de la proteína de pico real S protein_mut fueron cambiados con más C y G que podrían agregarse, respetando los sinónimos en la tabla estándar del código genético, con sustitución de aminoácidos Lisina ( AAA) y valina (GUU) con prolina (CUU) para evitar que la proteína diseñada colapse. Al final de esta secuencia hay 2 codones de parada. No está totalmente demostrado que con esta sustitución se formen los mismos elementos y no se produzcan malas interpretaciones.
3′-UTR (primera región 3 no traducida): se suponía que indicaría la dirección de traducción de la secuencia y mejoraría la síntesis de proteínas, sin embargo, muchas de sus funciones siguen siendo desconocidas; Por tanto, es imposible verificar su seguridad. Lo que se sabe lo afirma la OMS y es la siguiente frase: La 3′ UTR de la vacuna BioNTech/Pfizer se tomó del “potenciador amino terminal del ARNm dividido (AES) y del ARN ribosomal 12S codificado mitocondrial”.
poli(A): Luego llegamos al final de la secuencia y encontramos 30 A, luego un enlace GCAUAUGACU de 10 nucleótidos, seguido de otras 70 A, ya que el organismo puede reutilizar cada ARNm varias veces.
Cuando la A se agota, el ARNm se degrada.
Todas ellas son modificaciones patentadas para aumentar la expresión de proteínas, de las que no se sabe nada sobre la traducción real que lleva a cabo el organismo.
Anomalías y otros errores en empalmes alternativos
Otro problema relacionado es que el mismo pre-ARNm puede dar lugar a diferentes ARNm maduros y, por tanto, a proteínas ligeramente diferentes (anomalías de empalme alternativo). Se ha descubierto que un cambio en el proceso de síntesis de proteínas es la causa del desarrollo y crecimiento de algunos cánceres y otras enfermedades sin cambiar el ADN de ninguna manera.
Todos los eventos de empalme identificados en los tres genes de la serie PHT implican la pérdida del marco de lectura de la secuencia mensajera y la introducción de un codón de terminación prematura (PTC), que siempre está a más de 50-55 nucleótidos aguas arriba del último exón. exon Connection son las transcripciones alternativas del sistema de vigilancia NMD (desintegración de ARNm mediada sin sentido). Para slc15a4/PHT1 humano y de rata, esto se demostró mediante experimentos de inhibición de NMD en varias líneas celulares, en las que la expresión de variantes alternativas a las transcripciones canónicas siempre se estabilizó después de la inhibición.(4)
Conclusiones
Posibles riesgos a largo plazo para la salud humana
Podemos decir que la secuencia, además de no estar optimizada, plantea fuertes dudas sobre la presencia de errores en el uso de codones. Es posible especular que la modificación excesiva destinada a un aumento extremo en la expresión de proteínas puede ser la fuente de error en el ensamblaje de la secuencia del gen del ARNm.
La alteración en la disponibilidad de ARNt puede provocar enfermedades neurodegenerativas (Ishimura et al., 2014), y la regulación positiva de ARNt específicos promueve la metástasis al aumentar la estabilidad de las transcripciones enriquecidas en sus codones afines.(5)
Los errores de traducción tienen consecuencias muy graves para la fisiopatología de una variedad de enfermedades, incluidas la esclerosis múltiple, la neurodegeneración, la miopatía mitocondrial, la encefalopatía, la acidosis láctica, los episodios similares a los accidentes cerebrovasculares, la enfermedad de Parkinson y el cáncer (génesis, aceleración del crecimiento y metástasis).(6 )
En este caso, la correlación entre el aumento de la tasa de síntesis de proteínas de 100 % con los errores de traducción de la secuencia, así como el mecanismo que influye en la producción de aminoácidos, sigue siendo oscura porque muchos experimentos aún no se han llevado a cabo.
Básicamente, se puede decir que el código de la secuencia general está intrínsecamente desequilibrado, demasiado comparado con el homólogo viral natural, y demasiado para decir que el organismo humano reproduce las proteínas S-spike exactamente, como una imagen exactamente idéntica, lo que plantea un riesgo de daños graves a largo plazo para la salud humana, además de una inmunización inadecuada.
Lo que se produce a partir de esta secuencia está lejos de estar definido con precisión, pero está escrito en los genes de cada individuo, a través del perfil ribosómico, cómo se traduce y qué se produce, es decir, el beneficio o daño que se provoca.
Referencias
1. Ou X, Cao J, Cheng A, Peppelenbosch MP, Pan Q (2019) Errores en la decodificación traduccional: ¿bamboleo del ARNt o incorporación errónea? PLoS Genet 15(3):e1008017. https://doi.org/10.1371/journal.pgen.1008017
2. Biomoléculas 2020, 10(5),729; https://doi.org/10.3390/biom10050729
3. Robinson R (2014) ¿Qué sinónimo de codón es mejor? Puede depender de lo que haya en el menú. PLoS Biol 12(12):e1002014. doi:10.1371/journal.pbio.1002014
4. Andries, O. (2015). Estrategias de modificación y entrega de ARNm para establecer una plataforma para una terapia génica segura y eficaz. Universidad de Gante. Facultad de Medicina Veterinaria, Merelbeke, Bélgica.
5. eLife 2019;8:e45396 DOI: 10.7554/eLife.45396
6. Mafalda Santos, Patricia M. Pereira, A. Sofia Varanda, Joana Carvalho, Mafalda Azevedo, Denisa D. Mateus, Nuno Mendes, Patricia Oliveira, Fábio Trindade, Marta Teixeira Pinto, Renata Bordeira-Carriço, Fátima Carneiro, Carl Rui Vitira .ino, Olive y Manuel AS Santos (2018) Los ARNt que interpretan erróneamente codones promueven el crecimiento tumoral en ratones, RNA Biology, 15:6, 773-786, DOI: 10.1080/15476286.2018.1454244
Los estudios confirman la reprogramación del sistema inmunológico mediante vacunas de ARNm y vectores
Stephanie Seneff del Instituto Tecnológico de Massachusetts y Greg Nigh de Naturopathic Oncology en Portland, un equipo de investigación del Centro Helmholtz para la Investigación de Infecciones, la Facultad de Medicina de Hannover, la Universidad de Bonn, así como médicos e investigadores del Centro Médico Erasmus de Rotterdam. llegar a resultados consistentes
El objetivo de los estudios es la reducción del sistema inmunológico humano inducida por sustancias de ARNm frente a los llamados receptores tipo herramienta. Estos se encargan de reconocer las estructuras de patógenos bacterianos y virales.
El estudio por Stephanie Seneff y des Equipos de investigación del Instituto Helmholtz están disponibles para descargar aquí.
Eso también PEI (Instituto Paul Ehrlich) ya señala los anticuerpos que aumentan la carga viral a partir del 30 de julio de 2020 (!) (sitio web como descargar PDF):
“Los anticuerpos que potencian la infección no provocan la eliminación o neutralización del virus, sino que permiten que el virus se una a los llamados receptores Fcγ, que se encuentran, entre otras cosas, en células inmunes especializadas (los llamados fagocitos). Esto, a su vez, permite que el virus sea absorbido por estas células, donde luego puede multiplicarse. Este proceso puede conducir a un aumento de la carga viral”.
El mayor riesgo de trombosis causado por el ARNm y las sustancias vectoriales empeora la situación. La prueba del dímero D se puede utilizar para estimar y detectar microscópicamente la probabilidad de un mayor riesgo de trombosis.
El valor de referencia para adultos es <0,5 mg/l. Los valores entre 0,5 y 3,0 mg/l se definen como ligeramente elevados, los valores > 4,0 mg/l como muy elevados.
Estudiar CON
– Resumen (traducción DE)
“La Operación Warp Speed lanzó dos vacunas de ARNm en Estados Unidos, las de Pfizer y Moderna. Los datos preliminares sugirieron una alta eficacia para estas dos vacunas, lo que ayudó a legitimar la Autorización de uso de emergencia (EUA) de la FDA.
EUA (Autorización de Uso de Emergencia) por la FDA. Sin embargo, el desarrollo excepcionalmente rápido de estas vacunas a través de ensayos controlados y el uso masivo de estas vacunas plantea numerosas preocupaciones sobre su seguridad. En esta revisión, primero describimos en detalle la tecnología subyacente a estas vacunas. Posteriormente, tanto los componentes de estas vacunas como la respuesta biológica prevista a estas vacunas, incluida la producción de la propia proteína de pico, y su posible relación con una amplia gama de patologías agudas y a largo plazo, como enfermedades de la sangre, enfermedades neurodegenerativas y enfermedades autoinmunes. En el contexto de estas patologías potencialmente inducidas, discutimos la importancia de las secuencias de aminoácidos dentro de la proteína de pico que están relacionadas con la proteína priónica. También ofrecemos una breve descripción de
Estudios que muestran el potencial de "desprendimiento" de proteínas de pico, la transferencia de la proteína de una persona vacunada a una
persona no vacunada, lo que provoca síntomas en esta última. Por último, abordaremos un punto frecuentemente discutido: la cuestión de si estas vacunas podrían o no cambiar el ADN de los vacunados. Si bien no hay estudios que respalden definitivamente esto, presentamos un escenario plausible, respaldado por vías ya establecidas de transformación y transporte de material genético, mediante las cuales el ARNm inyectado podría finalmente incorporarse al ADN de la célula germinal y transmitirse de generación en generación. Concluimos con nuestras recomendaciones de seguimiento para aclarar los efectos a largo plazo de estos medicamentos experimentales y evaluar mejor la verdadera relación riesgo-beneficio de estas nuevas tecnologías.„
…
– Conclusión (traducción DE)
„Se dice que las vacunas experimentales de ARNm tienen grandes beneficios, pero también plantean el riesgo de consecuencias trágicas e incluso catastróficas imprevistas. Las vacunas de ARNm contra el SARS-CoV-2 se introdujeron con gran fanfarria, pero hay muchos aspectos de su uso generalizado que suscitan preocupación. Hemos abordado algunas de estas preocupaciones aquí, pero no todas, y nos gustaría enfatizar que estas preocupaciones son potencialmente graves y pueden no hacerse evidentes durante años o incluso entre generaciones. Para eliminar los peligros adversos descritos en este documento, recomendamos al menos cumplir con los siguientes hallazgos de investigación y recomendaciones de seguimiento:
- Una encuesta nacional de datos detallados sobre eventos adversos asociados con las vacunas de ARNm, con amplio apoyo financiero y mucho más allá de las primeras semanas después de la vacunación.
- Pruebas repetidas de autoanticuerpos en la población vacunada. Los autoanticuerpos probados
podría estandarizarse y debería basarse en anticuerpos y autoanticuerpos previamente documentados que pueden ser desencadenados por la proteína de pico. Estos incluyen autoanticuerpos contra fosfolípidos, colágeno, actina, tiroperoxidasa (TPO), proteína básica de mielina, transglutaminasa tisular, transglutaminasa y posiblemente otros. - Perfiles inmunológicos relacionados con el equilibrio de citoquinas y efectos biológicos asociados. Las pruebas deben incluir al menos IL-6, INF-α, dímeros D, fibrinógeno y proteína C reactiva.
- Estudios que comparan poblaciones vacunadas con vacunas de ARNm y aquellas no vacunadas para confirmar la menor tasa de infección esperada y síntomas más leves del grupo vacunado, al tiempo que comparan las tasas de enfermedades autoinmunes registradas.
- Estudios para evaluar si es posible que una persona no vacunada adquiera formas específicas de las proteínas de pico de una persona vacunada en estrecha proximidad.
- Estudios in vitro para aclarar si las nanopartículas de ARNm pueden ser absorbidas por los espermatozoides y convertidas en plásmidos de ADNc.„
Estudiar Instituto Helmholtz
– Resumen (traducción DE)
„La vacuna BNT162b2 basada en ARNm de Pfizer/BioNTech fue la primera COVID-19 registrada y ha demostrado ser eficaz para prevenir infecciones por SARS-CoV-2 de hasta 95 %.
Se sabe poco sobre los efectos generales de la nueva clase de vacunas de ARNm, en particular si tienen efectos combinados sobre las respuestas inmunes innatas y adaptativas. Aquí, confirmamos que la vacunación con BNT162b2 de individuos sanos provoca una inmunidad humoral y celular eficaz contra múltiples variantes del SARS-CoV-2. Curiosamente, sin embargo, la vacuna BNT162b2 también moduló la producción de citocinas inflamatorias por parte de células inmunitarias innatas después de la producción de citocinas inflamatorias por parte de células inmunitarias innatas, tanto cuando se estimula con estímulos específicos (SARS-CoV-2) como no específicos (virales, fúngicos y estímulos bacterianos).
La respuesta de las células inmunes innatas a los ligandos TLR4 y TLR7/8 fue menor después de la vacunación con BNT162b2, mientras que las respuestas de citoquinas inducidas por hongos fueron más fuertes. En conclusión, la vacuna de ARNm BNT162b2 da como resultado una reprogramación funcional compleja de las respuestas inmunes innatas, que debe tenerse en cuenta en el desarrollo y uso de esta nueva clase de vacunas.
…
En resumen, nuestros datos muestran que la vacuna BNT162b2 tiene efectos tanto en la rama adaptativa como en la innata de la inmunidad y que estos efectos son diferentes para las diferentes cepas de SARS-CoV-2.
Curiosamente, la vacuna BNT162b2 también provoca la reprogramación de la respuesta inmune innata. Es de destacar: combinado con fuertes respuestas inmunes adaptativas, esto podría contribuir a una respuesta inflamatoria más equilibrada durante la infección por COVID-19, o podría contribuir a una respuesta inmune innata reducida al virus. La vacuna BNT162b2 protege claramente contra la COVID-19, pero aún no se conoce la duración de esta protección, y sería concebible que este conocimiento pudiera incorporarse a generaciones futuras de la vacuna para mejorar el alcance y la duración de la protección. Nuestros resultados deben confirmarse mediante la realización de estudios de cohortes más amplios en poblaciones con diversos orígenes mientras más estudios investigan las posibles interacciones entre BNT162b2 y otras vacunas.„
Letras de mano rojas
Las empresas farmacéuticas emiten cartas rojas cuando, entre otras cosas, han surgido riesgos de medicamentos previamente desconocidos o cuando se retiran del mercado lotes de medicamentos por razones de seguridad.
Esto también sucedió con todos los productos farmacéuticos (vacunas) contra el COVID-19:
Biotecnología/Pfizer
Jansen
- 26.04.2021 – https://csiag.de/wp-content/uploads/2021/09/Rote-Hand-Janssen-26.042021.pdf
- 19.07.2021 – https://csiag.de/wp-content/uploads/2021/09/Rote-Hand-Janssen-19.07.2021.pdf
AstraZeneca
- 24.03.2021 – https://csiag.de/wp-content/uploads/2021/09/Rote-Hand-AstraZeneca-24.03.2021.pdf
- 02.06.2021 – https://csiag.de/wp-content/uploads/2021/09/Rote-Hand-AstraZeneca-02.06.2021.pdf
- 23.06.2021 – https://csiag.de/wp-content/uploads/2021/09/Rote-Hand-AstraZeneca-23.06.2021.pdf
Información médica/folletos de vacunas COVID
Cada lote de un paquete de vacunas viene con un folleto informativo e información médica. Estos deberían constituir la base de la información antes de realizar la vacunación.
La información médica de los fabricantes está disponible aquí en forma de enlace de la EMA y como enlace de descarga en PDF. Los folletos informativos actualmente no están disponibles en línea o ya no están disponibles.
- Comirnaty – BioNTech
- Folleto informativo (PDF)
- Información médica (Apéndice I – EMA) – Información para usuarios – (PDF)
- Johnson & Johnson / Janssen
- Folleto informativo (PDF)
- Información médica (Apéndice I – EMA) – (PDF)
- Spikevax – Moderna
- Folleto informativo (PDF)
- Información médica (Apéndice I – EMA) – (PDF)
- Vaxzevria – AstraZeneca
- Folleto informativo (PDF)
- Información médica (Apéndice I – EMA) – Información médica (Fabricante) - (PDF)
En la información proporcionada anteriormente por el fabricante, el propósito de la vacuna se define predominantemente como "prevenir las enfermedades COVID". No se garantiza una protección completa contra futuras infecciones por COVID.
AstraZeneca también señala el tema de las “creencias religiosas”:
"Cada uno debería decidir por sí mismo si su tratamiento es compatible con sus propias creencias religiosas".
Resultados de la autopsia de una persona que murió poco después de la vacunación de BioNTech
Bajo el título Primer caso de estudio postmortem en un paciente vacunado contra el SARS-CoV-2 del 16 de abril de 2021 fue el resultado de un estudio realizado en colaboración con el Instituto de Patología del Hospital Universitario OWL de la Universidad de Bielefeld, Campus Lippe, Röntgenstr. 18, D-32756 Detmold y el Instituto de Patología del KRH Hospital Nordstadt, Hannover, Alemania publicaron la autopsia aquí está disponible como PDF en el original.
El texto completo está traducido al alemán:
Resumen
Un hombre de 86 años previamente asintomático recibió la primera dosis de la vacuna COVID-19 de ARNm BNT162b2. Murió 4 semanas después de insuficiencia renal y respiratoria aguda. Aunque no tenía síntomas específicos de COVID-19, dio positivo por SARS-CoV-2 antes de su muerte. La unión al antígeno de la proteína de pico (S1) mostró niveles significativos de inmunoglobulina (Ig) G, mientras que la IgG/IgM de la nucleocápside no se activó. En la autopsia se asignó como causa de muerte la bronconeumonía aguda y la insuficiencia tubular; Sin embargo, no observamos ninguna característica morfológica distintiva de COVID-19. El mapeo molecular postmortem mediante reacción en cadena de la polimerasa en tiempo real reveló umbrales relevantes del ciclo del SARS-CoV-2 en todos los órganos examinados (orofaringe, mucosa olfatoria, tráquea, pulmones, corazón, riñón y cerebro), excepto el hígado y el bulbo olfatorio. Estos resultados pueden indicar que la primera vacunación induce inmunogenicidad pero no inmunidad estéril.
Informamos sobre un hombre de 86 años residente de una residencia de ancianos que fue vacunado contra el SARS-CoV-2. Los antecedentes médicos previos incluían hipertensión arterial sistémica, insuficiencia venosa crónica, demencia y cáncer de próstata. El 9 de enero de 2021, el hombre recibió la vacuna de ARN modificada con nucleósidos BNT162b2, formulada con nanopartículas lipídicas, en una dosis de 30 μg. Ese día y durante las siguientes 2 semanas no presentó síntomas clínicos (Tabla 1). El día 18, fue hospitalizado por un empeoramiento de la diarrea. Como no mostró ningún signo clínico de COVID-19, no fue aislado en un entorno específico. Los exámenes de laboratorio revelaron anemia hipocrómica y niveles elevados de creatinina sérica. La prueba de antígenos y la reacción en cadena de la polimerasa (PCR) para SARS-CoV-2 resultaron negativas.


Se realizaron gastroscopia y colonoscopia para investigar más a fondo la causa de la diarrea. En particular, la colonoscopia reveló una lesión ulcerosa del ángulo colónico izquierdo, que histológicamente se diagnosticó como colitis isquémica. El análisis por PCR de muestras de biopsia utilizando un método previamente informado (Kaltschmidt et al., 2021) fue negativo para SARS-CoV-2. El tratamiento fue de soporte con mesalazina y reposición de hierro intravenoso. Posteriormente, el estado del paciente se deterioró con el desarrollo de insuficiencia renal. El día 24, un paciente dio positivo por SARS-CoV-2 en la misma habitación del hospital que nuestro caso. El día 25, nuestro paciente dio positivo para SARS-CoV-2 mediante PCR en tiempo real (RT-PCR), con un umbral de ciclo (Ct) bajo que indica una carga viral alta. Tras un análisis más detallado de la muestra de hisopo, no hubo evidencia de las variantes mutadas del SARS-CoV-2 B.1.1.7, B.1.351 o B.1.1.28.1. En conjunto, parece que el paciente fue infectado por el paciente en su habitación del hospital. Nuestro paciente presentó ahora fiebre y dificultad para respirar, y la auscultación pulmonar mostró crepitantes. A pesar de iniciar oxígeno suplementario (2 L por minuto) y antibioterapia con ceftriaxona, el paciente falleció por insuficiencia renal y respiratoria aguda al día siguiente.
La evaluación de la inmunogenicidad midiendo la mungglobulina (Ig) G fijadora de antígeno de la proteína de pico (S1) en muestras de suero obtenidas el día 25 mostró una respuesta de anticuerpos (8,7 U/ml, valor de referencia 1,0 U/ml; Roche ECLIA™). Estos resultados indican que el paciente ya había desarrollado una inmunogenicidad relevante mediante la vacunación.
Los estudios post mortem mostraron bronconeumonía bilateral aguda con abscesos a veces rodeados de cocos bacterianos (Figura 1). No hubo hallazgos de manifestaciones comúnmente reportadas de neumonitis asociada a COVID-19. En el corazón encontramos hipertrofia biventricular (peso 580 g) y miocardiopatía isquémica diagnosticada histológicamente. Hemos detectado amiloidosis tipo transtiretina en el corazón y, en menor medida, en los pulmones. Los riñones mostraron daño crónico con arteriolosclerosis y fibrosis intersticial e insuficiencia renal aguda con degeneración tubular hidrópica. El examen cerebral reveló necrosis del tejido pseudoquístico parietal izquierdo, que se diagnosticó como una antigua zona de infarto.

La figura anterior se encuentra aquí Disponible para descargar en alta resolución como PDF.
Realizamos un mapeo molecular de 9 partes anatómicas diferentes de tejido incluido en parafina fijado con formalina como se describió anteriormente (Kaltschmidt et al., 2021). El ARN se extrajo de secciones de parafina utilizando Maxwell RSC (Promega, Madison, WI, EE. UU.). El análisis de RT-PCR múltiple se centró en 2 genes independientes del genoma del SARS-CoV-2 (kit fluorotipo SARS-CoV-2 plus; HAIN/Bruker, Nehren, Alemania): ARN polimerasa dependiente de ARN (objetivo 1) y nucleopéptido (objetivo 2). El valor de corte negativo fue Ct >45. Examinamos 9 muestras de tejido diferentes en busca de rutas conocidas y relevantes de propagación viral en el cuerpo humano (Figura 1). Para evitar la contaminación cruzada, cada muestra se incrustó directamente en casetes de tejido separados y se fijó por separado en formalina tamponada con solución salina tamponada con fosfato 4%. Demostramos ARN viral en casi todos los órganos examinados excepto el hígado y el bulbo olfatorio (Figura 1).
Hasta donde saben los autores, no se ha informado de un estudio de autopsia detallado que incluya un mapeo viral molecular de un paciente vacunado contra el SARS-CoV-2 con una prueba de SARS-CoV-2 posvacunación positiva. Proponemos que un solo tratamiento con la vacuna de ARN BNT162b2b2 indujo una inmunogenicidad significativa, como se refleja en los niveles séricos de IgG neutralizantes basados en proteínas de pico informados. Desde las semanas previas a la vacunación, durante la vacunación (día 1), hasta poco antes de la muerte (día 24), el paciente estuvo libre de síntomas clínicos típicamente atribuidos a COVID-19. Además, los análisis de sangre no mostraron títulos de IgM, que generalmente se observan entre 7 y 14 días después de la aparición de los síntomas (Kim et al., 2020). Sin embargo, el paciente dio positivo por SARS-CoV-2. Tanto el valor de ct medido en hisopos nasofaríngeos como los valores medidos en muestras de autopsia fijadas con formalina e incluidas en parafina indican carga viral y sugieren transmisibilidad. Dado que nuestro paciente murió aproximadamente 2 días después de su primer resultado positivo en la prueba de SARS-CoV-2, asumimos que los datos del mapeo molecular reflejan una etapa temprana de la infección viral. Una etapa temprana de la infección también podría explicar por qué varias regiones, como el bulbo olfatorio y el hígado, no se vieron (todavía) afectadas por la propagación viral sistémica.
Todavía no hemos observado ninguna característica morfológica distintiva de COVID-19 que se haya informado en estudios de autopsias morfológicas a gran escala (Schaller et al., 2020, Edler et al., 2020, Ackermann et al., 2020). No encontramos signos típicos de daño alveolar difuso en los pulmones, pero identificamos una bronconeumonía aguda extensa, posiblemente de origen bacteriano. Concluimos que el paciente falleció por bronconeumonía e insuficiencia renal aguda.
Nuestros resultados son consistentes con hallazgos previos de modelos animales de que la inmunización contra el SARS-CoV-2 mediante vacunación parecía reducir la gravedad de la patogénesis, particularmente con respecto a la enfermedad pulmonar grave, mientras que el ARN viral persistía en los hisopos nasales (Van Doremalen et al., 2020, Vogel et al., 2021). Recientemente, Amit et al. (2021) Resultados de un ensayo clínico en trabajadores de la salud que utilizaron la vacuna BNT162b2, que mostró reducciones tempranas significativas en la infección por SARS-CoV-2 y las tasas de COVID-19 sintomático después de la administración de la primera dosis de la vacuna.
De las principales reacciones adversas en pacientes vacunados contra el SARS-CoV-2 predominan los efectos locales y rara vez se describen reacciones sistémicas graves (Yuan et al., 2020). Sin embargo, informes recientes sobre un mayor riesgo de coágulos sanguíneos, en particular trombosis de los senos venosos cerebrales en el caso de la vacuna Oxford-AstraZeneca (Mahase 2021), generaron un debate sobre la seguridad de la vacuna COVID-19 en general. Es necesario realizar un análisis exhaustivo de los datos de las autopsias para proporcionar información más detallada sobre los efectos secundarios fatales y las muertes asociadas con las vacunas.
En conclusión, los resultados de nuestro estudio de caso de autopsia en un paciente con vacuna de ARNm confirman la opinión de que la inmunogenicidad ya puede inducirse con la primera vacunación contra el SARS-CoV-2, mientras que la inmunidad estéril no está suficientemente desarrollada.
Expresiones de gratitud
Nos gustaría agradecerle el apoyo técnico experto de Ralf Bode y Nadine Weber (Hospital Universitario OWL de la Universidad de Bielefeld, Campus Lippe, Detmold).
Referencias
- Ackermann M., Verleden SE, Kuehnel M., Haverich A., Welte T., Laenger F. Endotelialitis vascular pulmonar, trombosis y angiogénesis en Covid-19. N Inglés J Med. 2020;383:120–128. doi: 10.1056/NEJMoa2015432. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada] [Google Académico]
- Amit S., Regev-Yochay G., Afek A., Kreiss Y., Leshem E. Reducciones tempranas de la tasa de infección por SARS-CoV2 y COVID-19 en los receptores de la vacuna BNT162b2. Lanceta. 2021;397(10277):875–877. doi: 10.1016/S0140-6736(21)00448-7. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada] [Google Académico]
- Edler C., Schröder AS, Aepfelbacher M., Fitzek A., Heinemann A., Heinrich F. Morir con infección por SARS-CoV2: un estudio de autopsia de los primeros 80 casos consecutivos en Hamburgo, Alemania. Int J Legal Med. 2020;134:1275–1284. doi: 10.1007/s00414-020-02336-7. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada] [Google Académico]
- Kaltschmidt B., Fitzek ADE, Schaedler J., Förster C., Kaltschmidt C., Hansen T. Vasculopatía hepática y respuestas regenerativas del hígado en casos fatales de COVID-19. Clin Gastroenterol Hepatol. 2021 doi: 10.1016/j.cgh.2021.01.044. En prensa. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada] [Google Académico]
- Kim DS, Rowland-Jones S, Gea-Mallorqui E. ¿La infección por SARS-CoV-2 provocará una inmunidad protectora o esterilizante duradera? Implicaciones para las estrategias de vacunación. Inmunol frontal. 2020;11:571481. doi: 10.3389/fimmu.2020.571481.eCollection2020. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada] [Google Académico]
- Mahase E. Covid-19: la vacuna AstraZeneca no está relacionada con un mayor riesgo de coágulos sanguíneos, según la Agencia Europea de Medicamentos. BMJ. 2021;372:n774. doi: 10.1136/bmj.n774. [PubMed] [Referencia cruzada] [Google Académico]
- Schaller T., Hirschbühl K., Burkhardt K., Braun G., Trepel M., Märkl B. Exámenes postmortem de pacientes con COVID19. JAMA. 2020;323:2518–2520. doi: 10.1001/jama.2020.8907. [Artículo gratuito de PMC] [PubMed] [Referencia cruzada] [Google Académico]
- Van Doremalen N, Lambe T, Spencer A, Belij-Rammersdorfer S, Purushotham JN, Port JR La vacuna ChAdOx1 nCoV-19 previene la neumonía por SARS-CoV-2 en macacos rhesus. Naturaleza. 2020;586:578–582. doi: 10.1101/2020.05.13.093195. [PubMed] [Referencia cruzada] [Google Académico]
- Vogel AB, Kanevsky I, Che Y, Swanson KA, Muik A, Vormehr M. Las vacunas inmunogénicas BNT162b protegen a los macacos rhesus del SARS-CoV-2. Naturaleza. 2021;592(7853):283–289. doi: 10.1101/2020.12.11.421008. [PubMed] [Referencia cruzada] [Google Académico]
- Yuan P., Ai P., Liu Y., Ai Z., Wang Y., Cao W. Seguridad, tolerabilidad e inmunogenicidad de las vacunas COVID19: una revisión sistemática y un metanálisis. medRxiv. 2020 doi: 10.1101/2020.11.03.20224998. Preimpresión. [Referencia cruzada] [Google Académico]
Resultados de la investigación sobre el extracto de diente de león: inhibe la unión de las proteínas de pico
Extracto de texto/traducción del artículo “INVESTIGACIÓN: El extracto de hoja de diente de león impide que las proteínas de pico se unan al receptor de la superficie celular ACE2„:
Las proteínas de pico del SARS-CoV-2 pueden neutralizarse con una "mala hierba" común que se prohíbe en el césped todos los años. uno alemán estudio universitario reveló que el diente de león (Taraxacum officinale) puede bloquear la unión de las proteínas de pico a los receptores de la superficie celular ACE2 en las células de los pulmones y los riñones humanos. El extracto de diente de león a base de agua, derivado de las hojas secas de la planta, fue eficaz contra la proteína de pico D614 y una variedad de cepas mutantes, incluidas D614G, N501Y, K417N y E484K.
Aquí está la traducción al alemán del estudio original (PDF - Inglés) :
Resumen:
El 11 de marzo de 2020, la enfermedad por coronavirus 2019 (COVID-19), causada por el virus SARS-CoV-2, fue declarada pandemia mundial por la Organización Mundial de la Salud (OMS). Hasta la fecha, las nuevas “variantes preocupantes” del SARS-CoV-2, la británica (B.1.1.7), la sudafricana (B.1.351) o la brasileña (P.1), se están propagando rápidamente. Todos ellos contienen múltiples mutaciones en el sitio de reconocimiento del receptor ACE2 de la proteína Spike, en comparación con la secuencia original de Wuhan, lo cual es de gran importancia por su potencial de defensa inmune. Aquí, informamos la eficacia del diente de león (Taraxacum officinale) para bloquear la interacción proteína-proteína de Spike S1 con el receptor de superficie celular ACE2 humano. Esto podría demostrarse para el pico D614 original, pero también para sus formas mutadas (D614G, N501Y y mezcla de K417N, E484K, N501Y) en células humanas HEK293-hACE2-riñón y A549-hACE2-TMPRSS2. Los compuestos de alto peso molecular del extracto a base de agua son responsables de este efecto. El extracto previno eficazmente la infección de las células pulmonares con partículas de lentivirus pseudotipadas con picos de SARS-CoV-2, al igual que la secreción de interleucina-6 proinflamatoria desencadenada por el virus. Las monografías de hierbas modernas consideran seguro el uso de esta planta medicinal. Por lo tanto, los resultados in vitro aquí informados deberían estimular más investigaciones sobre la relevancia clínica y la aplicabilidad del extracto como estrategia de prevención de la infección por SARS-CoV-2.
El SARS-CoV-2 muta constantemente durante la transmisión entre personas. Esto podría eventualmente llevar al virus a evadir los enfoques terapéuticos y profilácticos existentes que se dirigen a la proteína de pico. Encontramos una inhibición efectiva de la interacción proteína-proteína entre el receptor de entrada de células virales humanas ACE2 y la proteína de pico del SARS-CoV-2, incluidas cinco mutaciones relevantes, mediante extractos a base de agua de diente de león común (Taraxacum officinale). Esto se demostró in vitro utilizando células de riñón humano (HEK293) y pulmón (A549) que sobreexpresan las proteínas ACE2 y ACE2/TMPRSS2, respectivamente. El extracto previno eficazmente la infección de las células pulmonares con el lentivirus pseudotipado SARS-CoV-2. Los resultados exigen un análisis más profundo de la eficacia del diente de león en la prevención del SARS-CoV-2 y evidencia clínica confirmatoria.
Hasta la fecha, hay tres nuevas variantes del SARS-CoV-2 de rápida propagación, reportadas por primera vez en el Reino Unido (variante B.1.1.7), Sudáfrica (variante B.1.351) y Brasil (variante P.1), todas ellas de ellos comparten la mutación N501Y en la proteína de pico (5). Las variantes del SARS-CoV-2 con mutaciones de la proteína de pico D614G ahora predominan en todo el mundo. Además de D614G, B.1.351 contiene mutaciones de pico adicionales, incluidas tres mutaciones (K417N, E484K y N501Y) en RBD (6). Los datos preliminares sugieren un posible vínculo entre el aumento de la tasa de mortalidad observado con la mutación D614G y se sugiere que un cambio conformacional en la proteína de pico conduce a una mayor infectividad (7). Los cálculos de perturbación de energía libre para las interacciones de las mutaciones N501Y y K417N, tanto con el receptor ACE2 como con un anticuerpo derivado de pacientes con COVID-19, plantean preguntas importantes sobre la posible respuesta inmune humana y el éxito de las vacunas ya disponibles en (8) . Además, se informó una mayor resistencia de las variantes B.1.351 y B.1.1.7 a la neutralización de anticuerpos; para B.1.351, esto se debió principalmente a la mutación E484K en la proteína de pico (9).
La interferencia con el sitio de interacción entre la subunidad S1 del pico y ACE2 puede ser un objetivo importante para la terapia o la prevención (10). Los compuestos de origen natural pueden proporcionar cierta protección contra la invasión de células virales y tienen pocos o ningún efecto secundario. Aquí, informamos el potencial inhibidor del diente de león en la unión de la proteína Spike S1 RBD al receptor de superficie celular hACE2 y comparamos el efecto de la proteína Spike original D614 con sus mutaciones D614G, N501Y y Mix (K417N, E484K, N501Y). .
El diente de león común (Taraxacum officinale) pertenece a la familia de plantas Asteraceae, subfamilia Cichorioideae con muchas variedades y especies pequeñas. Es una hierba perenne originaria de las zonas templadas más cálidas del hemisferio norte, que habita en campos, bordes de caminos y sitios ruderales. T. officinale se consume como alimento vegetal, pero también se utiliza en la fitoterapia europea para enfermedades del hígado, la vesícula biliar, el tracto digestivo o enfermedades reumáticas. Las monografías herbarias modernas consideran que el uso de la planta es seguro y han evaluado el uso empírico de T. officinale con un resultado positivo. Las áreas de aplicación de T. officinale se enumeran en las monografías de la Comisión E alemana, la Cooperativa científica europea de fitoterapia (ESCOP) (11, 12) y la Asociación británica de medicina herbaria (13). La planta contiene una amplia gama de fitoquímicos, incluidos terpenos (lactonas sesquiterpénicas como el ácido taráxico y triterpenos), compuestos fenólicos (ácidos fenólicos, flavonoides y cumarinas) y polisacáridos (14). Se encontró que el compuesto fenólico predominante era el ácido chicórico (ácido dicafeoiltartárico). Los demás eran ácidos mono y dicafeoilquínicos, derivados del ácido tartárico, flavonas y glucósidos de flavonol. Además de estas clases de compuestos, las raíces contienen altas cantidades de inulina (15). Las formas farmacéuticas incluyen decocciones e infusiones acuosas, jugos de plantas frescas bombeados, tinturas hidroalcohólicas y grageas a base de extractos secos, que se utilizan como monopreparados (16), pero también como componentes integrales de medicamentos. Nuestra investigación se realizó utilizando extractos a base de agua de hojas de plantas. Descubrimos que los extractos de hojas bloqueaban eficazmente la proteína de pico o sus formas mutadas del receptor ACE2 utilizadas antes o después de la incubación y que los compuestos de alto peso molecular son responsables de este efecto. Una planta de la misma cepa (Cichorium intybus) podría tener efectos similares pero con menor potencia. El extracto previno eficazmente la infección de las células pulmonares humanas A549-hACE2-TMPRSS2 con el lentivirus pseudotipado SARS-CoV-2.
Resultados
T. officinale inhibe la unión de la espiga S1 - ACE2
Primero examinamos la inhibición de la interacción entre la proteína de pico RBD del SARS-CoV-2 y ACE2 utilizando extractos de hojas de T. officinale. La Figura 1A muestra la inhibición dependiente de la concentración de la unión de la espiga S1-ACE2 tras el tratamiento con extracto de T. officinale (CE50 = 12 mg/ml). Los extractos de C. intybus también mostraron inhibición de la unión dependiente de la concentración, pero con menor potencia que T. officinale (CE50 = 30 mg/ml) (Fig. 1B). Luego preparamos dos fracciones de hojas secas de T. officinale y achicoria y separamos los extractos en una fracción de alto peso molecular (>5 kDa) y una fracción de bajo peso molecular (<5 kDa). Como se muestra en la Figura 1C, los compuestos bioactivos estaban presentes principalmente en la fracción HMW. Sólo se observó una baja actividad en la fracción BPM.

.
Efecto de T. officinale y achicoria sobre el pico de Sars-CoV-2: inhibición de la ECA 2.
AB) Efecto dependiente de la concentración del extracto de T. officinale (TO) y C. intybus (CI). CD) Efecto de fracciones de extracto de hoja de TO y CI. Los extractos se liofilizaron y luego se realizó el fraccionamiento de peso molecular. El límite se estableció en 5 kDa (HMW > 5 kDa, LMW < 5 kDa). H+L: fracciones APM y BPM; Como referencia se utilizó 50 mg de hojas secas por ml de agua. Se utilizaron cantidades de fracciones de APM y BPM equivalentes a hojas secas. La inhibición de la unión se evaluó mediante la técnica ELISA. Las barras son medias + SD. Control de disolvente: agua destilada (ad).
Utilizando células HEK293 que sobreexpresan hACE2, se investigó más a fondo el potencial de los extractos de T. officinale y C. intybus para bloquear la unión de picos a las células. Como puede verse en la Figura 2, la preincubación de células con T. officinale durante un minuto. bloqueó efectivamente la unión celular de Spike en 76,67 % ± 2,9 y su fracción HMW en 62,5 ± 13,4% en comparación con el control de agua. Después de 3 h, la inhibición seguía siendo de 50 ± 13,6 % para el extracto y de 35,0 ± 20 % para la fracción APM de T. officinale. El extracto de achicoria fue menos eficaz en este sistema de prueba; La inhibición de la unión se observó a 37 ± 20 % después de 1 minuto. y 5,6 ± 9,9 %.

Inhibición de la unión de la proteína de pico S1 a células humanas HEK293-hACE2 mediante preincubación de extracto.
Las células se preincubaron durante los tiempos indicados con el extracto de 10 mg/ml de T. officinale (TO), su fracción de APM igual a 10 mg/ml de extracto (APM) y 10 mg/ml de C. intybus (CI). o control de disolvente (ad) y luego se trató con proteína de pico S1 marcada con HIS durante 1 hora sin un paso de lavado intermedio a 4°C. La inhibición de la unión se determinó mediante citometría de flujo. N=3, las barras son medias + DE. Arriba a la izquierda: citograma de células HEK-hACE2 cerradas. Medio: Superposición de histogramas de intensidad de fluorescencia representativos para la expresión de superficie de ACE2. Arriba a la derecha: superposición de histogramas representativos de intensidad de fluorescencia para la inhibición de la unión de picos por parte de los extractos o el anuncio; control positivo: 20 µg/ml de hACE2 soluble. Las células se tiñeron con anticuerpo monoclonal conjugado anti-His-tag Alexa Fluor 647.
El tratamiento celular con cantidades iguales de pico D614 y sus variantes D614G y N501Y confirmó una afinidad de unión más fuerte de D614G (~1,5 veces) y N501Y (~3 a 4 veces) que la proteína de pico D614 al receptor de superficie ACE2 de las células HEK293 ( Figura 3A). El pretratamiento rápido con T. officinale (en 30 s) bloqueó la unión de la espiga al receptor de superficie ACE2 (Fig. 3B-C). Después de 30 segundos, esto fue 58,2 ± 28,71 TP3T para D614, 88,2 ± 4,61 TP3T para D614G y 88 ± 1,31 TP3T para la inhibición de la unión de N501Y mediante extracto de T. officinale. Aunque se observó inhibición de la unión de picos para el extracto de C. intybus, esto fue aproximadamente 30-70% menor en comparación con T. officinale, dependiendo de la proteína de pico examinada. Cuando se examinó la unión a 37°C en lugar de 4°C, los resultados fueron comparables para T. officinale pero incluso más débiles para el extracto de achicoria en esta línea celular (Figura 3D). Para los extractos de T. officinale y C. intybus, la inhibición de la unión de las espigas fue de 47,90 ± 14,72 y 13,12 ± 12,37 (D614), 68,42 ± 14,53 y 8,86 ±, respectivamente 15,29 (D614G), 71,66 ± 7,66 y 37,56 ± 16,14 (N501Y). ) , respectivamente. También preguntamos si los extractos podrían reemplazar la unión de las espigas al receptor de superficie ACE2 de las células humanas. Para ello, primero incubamos las células con la proteína de pico D614, D614G o N501Y y luego con los extractos. Como se muestra en la Fig. 3D, T. officinale pudo eliminar eficazmente la punta del receptor (50% en promedio); La achicoria era mucho más débil entonces (en promedio 25 %). Ampliamos nuestros experimentos a células humanas A549-hACE2-TMPRSS2 y pudimos confirmar los resultados observados en células HEK293-hACE2 para T. officinale (Figura 3D-G). Esta línea celular se transfectó de forma estable con los genes humanos ACE2 y TMPRSS2 y, curiosamente, aquí el extracto de C. intybus fue más eficaz en comparación con las células HEK-hACE2. Después del pretratamiento del extracto, la inhibición de la unión de las espigas a las células osciló entre 73,5% ± 5,2 (D614) y 86,3% ± 3,23 (N501Y) para el extracto de T. officinale y entre 56,1% ± 5,28 (D614) y 63,07% ± 14,55 (N501Y). ) para el extracto de C. intybus. Ya a 0,6 mg/ml, T. officinale bloqueó significativamente la unión a la proteína de pico D614G en aproximadamente 40% (IC50 = 1,73 mg/ml). Cuando las células se preincubaron con la proteína de pico antes del tratamiento con extracto, los resultados para D614 y D614G fueron comparables para el extracto de T. officinale pero ligeramente inferiores para N501Y (Fig. 3C-D). También se probó en este entorno una mezcla de los mutantes de pico N501Y, K417N y E484K y aquí también el extracto de T. officinale bloqueó la unión en 82,97 % ± 6,31 (extracto antes de la incubación) y 79,7 % ± 9,15 (extracto después de la incubación).

Inhibición de la unión de Spike D614 y sus mutantes D614G, N501Y o una mezcla (N501Y, K417N y E484K) a células humanas HEK293-hACE2 y A549-hACE2-TMPRSS2 mediante extracto antes o después de la incubación.
Superposición del histograma de intensidad de fluorescencia para A) células HEK no teñidas, control de tinción (etiqueta anti-His A647) y células incubadas con punta etiquetada con His D614, D614G o N501Y durante 1 hora a 4 °C. B) Células preincubadas con control de disolvente (ad), 10 mg/ml de T. officinale (TO) o 10 mg/ml de C. intybus (CI) durante 30-60 segundos y luego con S1 etiquetado con His. Las proteínas Spike D614, D614G o N501Y se trataron durante 1 h sin lavado intermedio a 4 °C. DG) Efecto de la incubación del extracto en células HEK o A549 antes o después de la incubación con picos marcados con His D614, D614G, N501Y o proteína mixta (N501Y, K417N y E484K) a 37 °C. H) Se incubaron extractos de plantas en saliva de 4 donantes humanos durante 30 min. a 37°C. Luego, las células se trataron previamente con extractos de 5 mg/ml durante 60 segundos. a 37°C antes de la incubación con proteína Spike D614 marcada con His durante 0,5 h a 37°C. La inhibición de la unión de picos a células humanas se evaluó mediante análisis de citometría de flujo de células teñidas con anticuerpo monoclonal conjugado anti-His-tag Alexa Fluor 647. Las barras son medias + SD.
Los extractos incubados en saliva humana durante 30 minutos a 37 °C antes del tratamiento celular tuvieron efectos comparables sobre la inhibición del pico D614G (Fig. 3H), lo que indica una buena estabilidad de los compuestos bioactivos en la saliva.
Para ver si el extracto de T. officinale interrumpe la actividad catalítica del receptor ACE2 o afecta la expresión de la proteína ACE2, tratamos células A549-hACE2-TMPRSS2 con el extracto durante 1 a 24 h antes de la lisis y detección celular. No se observó pérdida de viabilidad celular después de 84 h de exposición de las células al extracto (Fig. 4A). No se pudo detectar ningún deterioro de la actividad enzimática después de 1 o 24 h (4B). Spike disminuyó significativamente la proteína ACE2 después de 6 horas (Figura 4C, barras negras), y esto también fue cierto para el extracto, ya sea solo (Figura 4C, barras blancas) o en combinación con Spike (barras negras). Este efecto se eliminó después de 24 horas (4D).

Efecto del extracto de T. officinale sobre la actividad de la enzima ACE2 y la expresión de proteínas.
A) La viabilidad de las células A549-hACE2-TMPRSS2 se determinó mediante tinción celular con azul tripano después de 84 h de exposición al extracto. B) Las células se incubaron con extracto TO o 500 ng/ml de proteína S1 y se analizaron para determinar la actividad enzimática utilizando un kit de fluorescencia. CD) Las células se expusieron durante 6 h o 24 h para extraer 500 ng/ml de proteína S1 sin (barras blancas) o con (barras negras) y se analizaron para determinar la expresión de la proteína ACE2 utilizando un kit ELISA ACE2 humano; a. d.: Control de disolventes. Las barras son medias + DE, N ≥ 3 experimentos independientes.
Utilizando un lentivirus pseudotipo de pico de SARS-CoV-2, luego examinamos si el extracto podría bloquear la entrada del virus mediante la inhibición de pico. Cuando se trató previamente con el extracto, la transducción del virus se redujo en aproximadamente 85% a 20 mg/ml (Fig. 5A). En las diferentes condiciones de tratamiento, la señal de luminiscencia generada por la transducción del virus fue inhibida por 70 % ± 16,7 (A), 58 % ± 9,6 (B) y 53 % ± 8,1 (C) a 10 mg/mL de extracto. Esta inhibición de la transducción del virus por el extracto estuvo acompañada de una supresión significativa de la respuesta inflamatoria desencadenada por el virus, según lo determinado por la secreción reducida de la citocina proinflamatoria IL-6 en las células A549-hACE2-TMPRSS2 (Fig. 5D).

Inhibición de la transducción viral de células A549-hACE2-TMPRSS2 por extracto de T. officinale.
Las células se transdujeron con 2,5 µl de lentivirus pseudotipado de pico de SARS-CoV-2 (Luc reporter) durante 24 h A) después del tratamiento previo con extracto de T. officinale (TO) durante 0,5 h, B) 3 h antes de la adición de TO o C) sin extracto . Luego se cambió el medio a medio nuevo y las células se incubaron junto con el extracto durante 60 h más. La luminiscencia se detectó después de 1 h. (-) Control negativo: pseudovirión lentiviral calvo; (+) control positivo: lentivirus luciferasa de luciérnaga. D) El análisis de la secreción de citoquinas proinflamatorias IL-6 se llevó a cabo después de 24 h de transducción del virus junto con el extracto (izquierda), después de 24 h + 60 h después de la infección con el extracto (centro) o después de 60 h después de la infección con el extracto (derecha) mediante multiplexación. análisis de citometría de flujo. Control de disolvente: agua destilada (ad). N ≥ 3 experimentos independientes.
discusión
El desarrollo de estrategias eficaces de prevención y tratamiento de la infección por SARS-CoV-2 aún se encuentra en sus primeras etapas. Aunque las primeras vacunas ya han recibido aprobación para su comercialización, aún persisten desafíos relacionados con la distribución o la efectividad a largo plazo, así como el riesgo de reinfección (17, 18). Sin embargo, las infecciones posteriores pueden ser más leves que la primera. Además de la vacunación contra el COVID-19, bloquear la accesibilidad del virus a la ACE2 unida a la membrana como receptor principal para ingresar a la célula diana del SARS-CoV-2 representa una estrategia alternativa para prevenir el COVID-19. Existen diferentes enfoques aquí (19. ), pero, por supuesto, cada una de estas estrategias de tratamiento también tiene sus desafíos fundamentales y traslacionales que deben superarse para obtener beneficios clínicos. Los obstáculos técnicos incluyen el potencial fuera del objetivo, los efectos independientes de ACE2, la estabilidad o la toxicidad (19). Los compuestos de origen natural podrían ser un recurso importante aquí porque están descritos a largo plazo y muchos de ellos se consideran seguros. Si bien los experimentos de acoplamiento in silico han implicado a varios productos naturales comunes como inhibidores de ACE2, aún no se ha demostrado que la mayoría de ellos inhiban la unión de picos a ACE2, lo que podría explicarse por una falta de cobertura completa de los residuos de unión de ACE2 por parte de los compuestos (20). . Sin embargo, para la glicirricina, la nobiletina y la neohesperidina, la unión de ACE2 cae parcialmente dentro de la región de contacto de RBD y, por lo tanto, se ha propuesto que bloqueen adicionalmente la unión de picos a ACE2 (20). Lo mismo se aplica a los inhibidores sintéticos de la ECA2, como la N-(2-aminoetil)-1-aziridina etanamina (NAAE) (21). Por el contrario, el antibiótico lipoglucopéptido dalbavancina ahora se ha identificado como un aglutinante de ACE2 y un inhibidor de ACE2 de pico de SARS-CoV-2 (22); Este compuesto inhibió eficazmente la infección por SARS-CoV-2 en modelos de ratón y mono rhesus. El bloqueo de la interacción Spike-ACE2 con 74 % también se demostró para un extracto hidroalcohólico de cáscara de granada, para sus componentes principales punicalagina con 64 % y ácido elágico con 36 %. Utilizando la infección por lentivirus pseudotipado con picos de SARS-CoV-2 de células de riñón humano 2 (HK-2), el extracto de cáscara bloqueó eficientemente la entrada del virus (23). En el presente estudio, demostramos una potente inhibición de la proteína RBD Spike S1 de ACE2 mediante extractos de T. officinale mediante un ensayo sin células y confirmamos este hallazgo al demostrar una inhibición eficiente de la unión a la superficie celular de ACE2 en dos líneas celulares humanas. Observamos una unión más fuerte de las variantes D614G y N501Y al receptor de superficie ACE2 de las células humanas, pero todas las variantes analizadas fueron sensibles a la inhibición de la unión por parte de T. officinale, ya sea antes o después de su uso. Hasta la fecha, varios estudios indican que el linaje del virus D614G es más infeccioso que el virus D614 (24). La presencia de mutaciones características como N501Y de, p. G. la denominada variante B.1.1.7 del Reino Unido, conduce a una mayor infectividad que la cepa original, lo que podría deberse a una mayor afinidad de unión entre la proteína de pico y ACE2 (25). Por lo tanto, nuestros hallazgos sobre los extractos de T. officinale pueden ser importantes aquí, ya que a medida que avance la pandemia surgirán nuevas variantes del virus de posible preocupación, que también pueden reducir la eficacia de algunas vacunas o conducir a mayores tasas de reinfección. Como se mencionó anteriormente, un problema en el desarrollo de productos para profilaxis de la infección por SARS-CoV-2 o para retardar la propagación sistémica del virus es la selectividad para la entrada de virus con baja toxicidad para el huésped. No se ha notificado ningún caso de sobredosis de T. officinale para las indicaciones médicas actuales (11, 13, 16). La dosis recomendada es de 4-10 g (aproximadamente 20-30 mg por ml de agua caliente) hasta 3 veces al día (Comisión E y ESCOP). Las contraindicaciones para el uso de T. officinale, según información de la Agencia Europea de Medicamentos (EMA), incluyen hipersensibilidad a la familia de plantas Asteraceae o sus ingredientes activos, enfermedades hepáticas y biliares, incluida la obstrucción de las vías biliares, cálculos biliares y colangitis, o enfermedades activas. estómago -Enfermedades intestinales úlcera (16). La planta es una fuente importante de potasio (26, 27) y por tanto advierte sobre el posible riesgo de hiperpotasemia. El uso en niños menores de 12 años, durante el embarazo y la lactancia no ha sido probado por falta o suficientes datos.
Si bien la actividad de la enzima ACE2 no se vio afectada por el extracto de T. officinale en el presente estudio, la proteína ACE2 se reguló negativamente de manera transitoria en la línea de células pulmonares que sobreexpresan ACE2, lo que requiere más atención en los estudios en curso. ACE2 es una importante monocarboxipeptidasa dependiente de zinc en la vía de señalización de renina-angiotensina, que es crucial para los efectos sobre los sistemas cardiovascular e inmunológico. Una alteración del equilibrio angiotensina II/angiotensina (1-7) a través de la inhibición de la actividad de la enzima ACE2 o la disminución de proteínas y una mayor cantidad de angiotensina II circulante en el sistema es, por ejemplo, G. reconoció que promueve el daño pulmonar asociado a la enfermedad COVID-19 (28, 29).
Se cree que el pulmón es el principal objetivo de interés, pero se ha encontrado expresión de proteínas y ARNm de ACE2 en las células epiteliales de todos los tejidos orales, particularmente en la mucosa bucal, los labios y la lengua (30). Estos datos son consistentes con la observación de cargas virales muy altas en la saliva de pacientes infectados por SARS-CoV-2 (31, 32). Por tanto, se considera que la cavidad bucal, como parte esencial del tracto aerodigestivo superior, desempeña un papel clave en la transmisión y patogenicidad del SARS-CoV-2. Existe una gran posibilidad de que prevenir la colonización viral en la mucosa oral y faríngea sea crucial para evitar una mayor infección de otros órganos y el brote de COVID-19 (33). Por lo tanto, se ha sugerido que los enjuagues bucales virucidas comerciales, principalmente povidona yodada, reducen potencialmente la carga viral del SARS-CoV-2 en personas infectadas (34-36), pero hasta la fecha no existen estudios clínicos significativos (36). El bloqueo de la unión del virus SARS-CoV-2 a las células de la cavidad bucal con extractos de T. officinale puede ser tolerable para un consumidor solo durante períodos de tiempo limitados (por ejemplo, la aplicación del producto después del contacto con personas infectadas o en caso de infección). Otros experimentos in vitro fisiológicamente relevantes que realizamos mostraron que solo eran necesarios tiempos de contacto cortos con el extracto de T. officinale para bloquear eficientemente la unión de las espigas del SARS-CoV-2 o para eliminar las espigas ya unidas de la superficie celular. Experimentos con virus de pico pseudotipados del SARS-CoV-2 proporcionaron más evidencia de relevancia. Aunque el uso de estos virus pseudotipados no permite evaluar la contribución de las características del virión, como las proteínas de la membrana o la envoltura, al tropismo celular (37), se consideran una herramienta útil para documentar la relevancia de ACE2 en los pasos de entrada celular promulgados por Spike. están mediados por proteínas.
Todas las vacunas candidatas desarrolladas tienen como objetivo generar respuestas de anticuerpos (y células T) contra la proteína de pico, y las secuencias de picos de la cepa temprana de Wuhan sirvieron de base en este caso (38). Sin embargo, el SARS-CoV-2 muta constantemente durante la transmisión continua entre personas. La deriva antigénica viral queda claramente demostrada por la reciente aparición de B.1.1.7, B.1.351 o B.1.1.28 (P.1). Está evolucionando para evadir potencialmente nuestros enfoques terapéuticos y profilácticos existentes que apuntan al pico viral. Por lo tanto, factores como la baja toxicidad en humanos y la inhibición eficaz de la unión de cinco mutaciones de pico relevantes en el receptor ACE2 humano, como se informa aquí in vitro, alientan un análisis más profundo de la eficacia de T. officinales en el SARS-CoV-2. prevención y ahora requiere más evidencia clínica confirmatoria.
Materiales y metodología
material vegetal
El estudio se llevó a cabo utilizando hojas secas de T. officinale (de Achterhof, Uplengen, Alemania; lote nº 37259, B370244 y P351756). En tres lugares diferentes de la región de Friburgo i. Gebr. (Alemania), el 12 de julio de 2020, y dio positivo en el ensayo de unión Spike S1-ACE2 sin células (datos no mostrados). C. intybus se compró a Naturideen (Alemania).
Líneas celulares y cultivos.
El Prof. Dr. Stefan Pöhlmann (Göttingen, Alemania). Las células se mantuvieron en medio Eagle modificado por Dulbecco (DMEM) con alto contenido de glucosa suplementado con 10 % de suero de ternera fetal (FCS), 100 U/ml de penicilina/estreptomicina y 50 μg/ml de Zeocin (Life Technologies, Darmstadt, Alemania). Se adquirieron células humanas A549-hACE2-TMPRSS2, generadas a partir de la línea celular A549 de pulmón humano, de InvivoGen SAS (Toulouse Cedex 4, Francia) y se mantuvieron en DMEM, alto contenido de glucosa suplementado con 10 % FCS inactivado por calor, 100 U/ml de penicilina. /estreptomicina, 100 µg/ml de normocina, 0,5 µg/ml de puromicina y 300 µg/ml de higromicina. Para el subcultivo, todas las células se enjuagaron primero con solución salina tamponada con fosfato (PBS) y luego se incubaron con tripsina-EDTA 0,251 TP3T hasta que se separaron. Todas las células se cultivaron a 37 °C en una incubadora humidificada con 5 % CO2/95 % atmósfera de aire.
Extractos de plantas
El material vegetal seco se pesó en un vial de vidrio de color ámbar (Carl Roth GmbH, Alemania) y se mezcló con agua de calidad HPLC (ad) a temperatura ambiente (RT). Luego, los extractos se incubaron durante 1 h y se centrifugaron a 16.000 g (3 min, TA). El sobrenadante se filtró (0,22 μm) antes de usarlo para experimentos.
Análisis del pico de SARS-COV2: inhibición de la interacción ACE2 mediante ELISA y citometría de flujo
Para la detección libre de células de la inhibición de la interacción Spike del SARS-CoV-2-ACE2, se utilizó un kit de detección de inhibidores del SARS-CoV-2 disponible comercialmente (Kat#: 16605302, Fisher Scientific GmbH, Schwerte, Alemania). Este ensayo ELISA colorimétrico mide la unión entre la proteína de pico RBD del SARS-CoV-2 inmovilizada y la proteína ACE2 humana biotinilada. La detección colorimétrica se realiza utilizando estreptavidina-HRP seguida de incubación con TMB. Un inhibidor del SARS-CoV-2 (hACE2) sirvió como referencia metodológicamente verificada.
La expresión de ACE2 en la superficie celular se determinó utilizando un anticuerpo humano conjugado con PE ACE2 (Bio-Techne GmbH, Wiesbaden-Nordenstadt, Alemania) y análisis de citometría de flujo. Para analizar la unión de SARS-CoV-2 S1 Spike RBD-ACE2, se trataron previamente 2 x 105 células (5 x 106 células/ml) con extractos de plantas en diferentes momentos. Luego se agregaron 500 ng/ml de SARS-CoV-2 Spike S1 (Trenzyme GmbH, Konstanz, Alemania), Spike S1 D614G, N50Y o una mezcla de K417N, E484K y N501Y (Sino Biological Europe GmbH, Eschborn, Alemania). a cada muestra se añadió y las muestras se incubaron adicionalmente durante 30-60 min. En otro entorno, las células se trataron previamente con 500 ng/ml de proteína recombinante Spike-His del SARS-CoV-2 durante 30 minutos antes de la incubación con el extracto de la planta durante 30 a 60 segundos a 4°C o 37°C. Las muestras se incubaron en tampón PBS que contenía 5% FCS. Luego, las células se lavaron una vez con tampón PBS que contenía 1% FCS a 500 x g durante 5 minutos antes de teñirlas con His-tag A647 mAb (Bio-Techne GmbH, Wiesbaden-Nordenstadt, Alemania) durante 30 minutos a temperatura ambiente. Luego las células se lavaron dos veces como se describe anteriormente. Las células se analizaron con un FACSCalibur (BD Biosciences, Heidelberg, Alemania), se adquirieron 10.000 eventos. La intensidad de fluorescencia media (MFI) de cada muestra se determinó utilizando el software FlowJo (Ashland, Oregon, EE. UU.).
Actividad de la enzima ACE2 humana y cuantificación de proteínas.
Se sembraron células A549-hACE2-TMPRSS2 (2 x 105) en una placa de 24 pocillos en medio DMEM con alto contenido de glucosa que contenía 10 % FCS inactivado por calor a 37 ° C, 5 % CO2. Luego, las células se trataron con extracto de T. officinale con/sin 500 ng/ml de proteína SARS-CoV-2 S1 Spike RBD durante 1 a 24 horas. Luego las células se lavaron con PBS y se lisaron. Se utilizaron 25 µg de proteína para cuantificar la proteína ACE2 (kit ELISA ACE2), 5 µg para la actividad de la enzima ACE2 (kit de ensayo de actividad ACE2, Abcam, Cambridge, Reino Unido) según las instrucciones del fabricante.
Infección de células A549-hACE2-TMPRSS2 con el lentivirus pseudotipado SARS-CoV-2
Las partículas de lentivirus pseudotipadas de SARS-CoV-2 Spike preparadas con SARS-CoV-2 Spike (acceso a Genbank #QHD43416.1) como glicoproteínas de envoltura en lugar del VSV-G comúnmente utilizado se compraron de BPS Bioscience (Catalog#: 7994299). , Biomol, Hamburgo). Estos pseudoviriones también contienen el gen de la luciferasa de luciérnaga, que es impulsado por un promotor del CMV. Por lo tanto, la entrada de células mediada por picos se puede cuantificar mediante la actividad indicadora de luciferasa. Como control negativo se utilizó el pseudovirión lentiviral calvo (BPS Bioscience #79943), en el que no se expresa ninguna glicoproteína de la envoltura. Se utilizó Firefly Luciferase Lentivirus (Puromycin) de BPS Bioscience (Catalog#: 79692-P) como control positivo para la transducción. Estos virus expresan constitutivamente luciferasa de luciérnaga bajo un promotor CMV. Las células pulmonares se cultivaron a 0,1 x 106 células/cm2 en placas de 96 pocillos en DMEM que contenían 10 % FCS inactivado por calor, 100 U/ml de penicilina/estreptomicina, 100 µg/ml de normocina, 0,5 µg/ml de puromicina y 300 µg/ml. . higromicina sembrada durante la noche. El medio se reemplazó con DMEM + 10 % FCS inactivado por calor y las células se trataron con extracto de ad o T. officinale 30 minutos antes o 3 h después de la adición de 2,5 µl de partículas de lentivirus. Después de 24 h de incubación de partículas de virus, el medio se eliminó lavando con PBS, se añadió medio nuevo y las células se incubaron durante otras 60 h con la adición de ad o extracto de T. officinale. La luminiscencia se detectó en 1 h utilizando el reactivo de luciferasa de un solo paso de BPS según el protocolo del fabricante en un lector multiplacas Tecan (Tecan Group Ltd, Crailsheim, Alemania).
Cuantificación de la liberación de citocinas mediante la técnica de perlas múltiples.
Cuantificación de la liberación de citocinas mediante la técnica de perlas múltiples. Después de 24 h de transducción de lentivirus pseudotipados con picos de SARS-CoV-2 y 60 h después de la infección de células A549-hACE2-TMPRSS2, los sobrenadantes se recogieron y almacenaron a -80 °C hasta el análisis de la secreción de citocinas con el ser humano. MACSplex. Se almacenó el kit Cytokine 12 (Miltenyi Biotec GmbH, Bergisch Gladbach, Alemania) según el protocolo del fabricante.
Fraccionamiento del peso molecular de extractos de plantas.
Se prepararon extractos de hojas de plantas secas añadiendo agua bidestilada (5 ml) al material vegetal (500 mg cada uno). Las muestras se incubaron en la oscuridad a temperatura ambiente (RT) durante 60 min, seguido de una centrifugación a 16.000 g durante 3 min. Los sobrenadantes se recogieron y se filtraron con membrana (0,45 μm), dando como resultado los extractos. Se liofilizaron alícuotas durante 48 horas para determinar su rendimiento en peso. Luego, los extractos se separaron en una fracción de alto peso molecular (HMW) y de bajo peso molecular (LMW) usando un tubo de centrifugación con un inserto con un filtro de corte de peso molecular (5 kDa, Sartorius Stedim Biotech, Göttingen, Alemania). convertirse. . Cada fracción de HMW se purificó enjuagando con 20 ml de agua, produciendo las fracciones de HMW así como las de LMW. Las fracciones se liofilizaron, se determinó su rendimiento en peso y se almacenaron a -20ºC hasta su uso.
Determinación de la viabilidad celular mediante tinción con azul tripán.
Determinación de la viabilidad celular utilizando azul tripán La viabilidad celular se evaluó mediante la prueba de exclusión del tinte azul tripán como se describió anteriormente (Odongo et al., 2017). Brevemente, se cultivaron células A549-hACE2-TMPRSS2 durante 24 h y luego se expusieron a extractos o control de disolvente (ad) durante 84 h.
Análisis estadístico
Los resultados se analizaron utilizando el software GraphPad Prism 6.0 (La Jolla, California, EE. UU.). Los datos se presentaron como media + DE. La significación estadística se determinó mediante la prueba ANOVA unidireccional seguida de la corrección de Bonferroni. Valores de p < 0,05 () se consideraron estadísticamente significativos y <0,01 (*) considerado altamente significativo estadísticamente.
Contribuciones del autor
Diseño y concepción del estudio: EL; Diseño experimental, adquisición de datos, análisis de datos: HTT, EL, NPKL; Preparación de fracciones de extracto: CD, MG; Redacción del primer borrador del manuscrito: EL. Todos los autores comentaron versiones anteriores del manuscrito.
Expresiones de gratitud
Los autores agradecen al Prof. Dr. Stefan Pöhlmann (Centro Alemán de Primates, Göttingen, Alemania) por proporcionar células de riñón embrionario humano 293 (HEK293) que expresan establemente hACE2.
Fuentes
- 1.↵Lu R, et al. (2020) Caracterización genómica y epidemiología del nuevo coronavirus de 2019: implicaciones para los orígenes del virus y la unión del receptor. Lanceta 395(10224):565–574.Referencia cruzadaPubMedGoogle Académico
- 2.↵Paules CI, Marston HD y Fauci AS (2020) Infecciones por coronavirus: más que solo el resfriado común. JAMA 323(8):707–708.Referencia cruzadaPubMedGoogle Académico
- 3.↵Berlin DA, Gulick RM y Martinez FJ (2020) Covid-19 grave. N Engl J Med 383(25):2451–2460.Referencia cruzadaPubMedGoogle Académico
- 4.↵Huang Y, Yang C, Xu XF, Xu W y Liu SW (2020) Propiedades estructurales y funcionales de la proteína de pico del SARS-CoV-2: posible desarrollo de fármacos antivirales para COVID-19. Acta Pharmacol Sin 41(9):1141–1149.Referencia cruzadaPubMedGoogle Académico
- 5.↵Grubaugh ND, Hodcroft EB, Fauver JR, Phelan AL y Cevik M (2021) Acciones de salud pública para controlar las nuevas variantes del SARS-CoV-2. Celúla.Google Académico
- 6.↵Zhou D, et al. (2021) Evidencia de escape de la variante B.1.351 del SARS-CoV-2 de sueros naturales e inducidos por vacunas. Celúla.Google Académico
- 7.↵Becerra-Flores M & Cardozo T (2020) La mutación G614 del pico viral del SARS-CoV-2 muestra una tasa de letalidad más alta. Revista internacional de práctica clínica 74(8):e13525.Google Académico
- 8.↵Fratev F (2020) Las mutaciones N501Y y K417N en la proteína de pico del SARS-CoV-2 alteran las interacciones tanto con hACE2 como con anticuerpos derivados de humanos: un estudio de energía libre de perturbación. bioRxiv:2020.2012.2023.424283.Google Académico
- 9.↵Ho D, et al. (2021) Mayor resistencia de las variantes B.1.351 y B.1.1.7 del SARS-CoV-2 a la neutralización de anticuerpos. Plaza Res.Google Académico
- 10.↵Perrotta F, Matera MG, Cazzola M y Bianco A (2020) Infección respiratoria grave por SARS-CoV2: ¿Importa el receptor ACE2? Respir Med 168:105996.Referencia cruzadaGoogle Académico
- 11.↵ESCOP (2003) “Taraxaci folium” y “Taraxaci radix”. Monografías sobre los usos medicinales de las drogas vegetales. (Thieme, Stuttgart) segunda ed., Ed. págs. 499–504.Google Académico
- 12.↵Blumenthal M, Busse WR, Goldberg A, Gruenwald J, Hall T, Riggins CW, Rister RS. (eds) “Hierba de diente de león” y “Raíz de diente de león con hierba” En: The Complete German Commission E Monographs. Guía terapéutica de medicamentos herbarios. Consejo Botánico Americano, Austin, Texas 1998; 118-120.13. Asociación BHM (1990) “Hoja de diente de león” y “Raíz de diente de león”. Farmacopea herbaria británica 1:37–39.Google Académico
- 14.↵González-Castejon M, Visioli F y Rodriguez-Casado A (2012) Diversas actividades biológicas del diente de león. Nutr Rev 70(9):534–547.PubMedGoogle Académico
- 15.↵Schutz K, Carle R y Schieber A (2006) Taraxacum: una revisión de su perfil fitoquímico y farmacológico. J Ethnopharmacol 107(3):313–323.Referencia cruzadaPubMedRed de cienciaGoogle Académico
- 16.↵Agencia Europea de Medicamentos (EMA) CoHMPH (2009) Informe de evaluación de Taraxacum officinale Weber ex Wigg., folium. HMPC/579634/2008.Google Académico
- 17.↵Para KK, et al. (2020) Reinfección por COVID-19 por una cepa de SARS-coronavirus-2 filogenéticamente distinta confirmada mediante secuenciación del genoma completo. Clin Infect Dis. 25 de agosto: ciaa1275. doi: 10.1093/cid/ciaa1275.Referencia cruzadaPubMedGoogle Académico
- 18.↵Edridge AWD, et al. (2020) La inmunidad protectora contra el coronavirus es de corta duración. medRxiv:2020.2005.2011.20086439.Google Académico
- 19.↵Jia H, Neptune E y Cui H (2020) Apuntando a ACE2 para la terapia COVID-19: oportunidades y desafíos. Revista estadounidense de biología molecular y células respiratorias. 9 de diciembre. doi: 10.1165/rcmb.2020-0322PS.Referencia cruzadaGoogle Académico
- 20.↵Zhou J y Huang J (2020) Hallazgos actuales sobre componentes naturales con posible actividad anti-2019-nCoV. Fronteras en biología celular y del desarrollo 8:589.Google Académico
- 21.↵Huentelman MJ, et al. (2004) Descubrimiento basado en la estructura de un nuevo inhibidor de la enzima convertidora de angiotensina 2. Hipertensión 44(6):903–906.Referencia cruzadaGoogle Académico
- 22.↵Wang G, et al. (2021) La dalbavancina se une a ACE2 para bloquear su interacción con la proteína de pico del SARS-CoV-2 y es eficaz para inhibir la infección por SARS-CoV-2 en modelos animales. Res. celular 31(1):17–24.Google Académico
- 23.↵Tito A, et al. (2020) Un extracto de cáscara de granada como inhibidor de la unión del pico del SARS-CoV-2 a la ACE2 humana: una fuente prometedora de nuevos fármacos antivirales. bioRxiv:2020.2012.2001.406116.Google Académico
- 24.↵Korber B, et al. (2020) Seguimiento de cambios en el pico de SARS-CoV-2: evidencia de que D614G aumenta la infectividad del virus COVID-19. Celda 182(4):812–827 e819.Referencia cruzadaPubMedGoogle Académico
- 25.↵Santos JC & Passos GA (2021) La alta infectividad del SARS-CoV-2 B.1.1.7 se asocia con una mayor fuerza de interacción entre Spike-ACE2 causada por la mutación viral N501Y. bioRxiv:2020.2012.2029.424708.Google Académico
- 26.↵Hook I, McGee A y Henman M (1993) Evaluación del diente de león para determinar la actividad diurética y la variación del contenido de potasio. Revista Internacional de Farmacognosia 31(1):29–34.Google Académico
- 27.↵Escudero NL, De Arellano ML, Fernández S, Albarracín G, & Mucciarelli S (2003) Taraxacum officinale como fuente de alimento. Alimentos vegetales para la nutrición humana 58(3):1–10.PubMedRed de cienciaGoogle Académico
- 28.↵Imai Y, et al. (2005) La enzima convertidora de angiotensina 2 protege de la insuficiencia pulmonar aguda grave. Naturaleza 436(7047):112–116.Referencia cruzadaPubMedRed de cienciaGoogle Académico
- 29.↵Kuba K, et al. (2005) Un papel crucial de la enzima convertidora de angiotensina 2 (ACE2) en la lesión pulmonar inducida por el coronavirus del SARS. Nat Med 11(8):875–879.Referencia cruzadaPubMedRed de cienciaGoogle Académico
- 30.↵Zhong M, et al. (2020) Las expresiones de ACE2 y furina en las células epiteliales orales posiblemente facilitan la infección por COVID-19 por vía respiratoria y fecal-oral. Front Med (Lausana) 7:580796.Google Académico
- 31.↵ Para KK-W, et al. (2020) Detección constante del nuevo coronavirus 2019 en la saliva. Enfermedades infecciosas clínicas: una publicación oficial de la Sociedad de Enfermedades Infecciosas de América 71(15):841–843.Referencia cruzadaPubMedGoogle Académico
- 32.↵Yoon JG, et al. (2020) Importancia clínica de una carga viral alta de SARS-CoV-2 en la saliva. J Korean Med Sci 35(20):e195–e195.Referencia cruzadaGoogle Académico
- 33.↵Wolfel R, et al. (2020) Evaluación virológica de pacientes hospitalizados con COVID-2019. Naturaleza 581(7809):465–469.Referencia cruzadaPubMedGoogle Académico
- 34.↵Seneviratne CJ, et al. (2020) Eficacia de los enjuagues bucales comerciales sobre la carga viral del SARS-CoV-2 en la saliva: ensayo de control aleatorio en Singapur. Infección: 1–7.Google Académico
- 35.↵ de Toledo Telles-Araujo G, Caminha RDG, Kallas MS, Sipahi AM y da Silva Santos PS (2020) Posibles enjuagues bucales y aerosoles nasales que reducen la carga viral del SARS-CoV-2: ¿qué sabemos hasta ahora? Clínicas (Sao Paulo) 75:e2328.Google Académico
- 36. Carrouel F, et al. (2021) Actividad antiviral de reactivos en enjuagues bucales contra el SARS-CoV-2. Revista de investigación dental 100(2):124–132.Google Académico
- 37.↵Joglekar AV & Sandoval S (2017) Vectores lentivirales pseudotipados: un vector, muchas formas. Métodos Hum Gene Ther 28(6):291–301.Referencia cruzadaGoogle Académico
- 38.↵Krammer F (2020) Vacunas contra el SARS-CoV-2 en desarrollo. Naturaleza 586(7830):516–527.Referencia cruzadaPubMedGoogle Académico
Consejo de Europa – Resolución 2361 (2021) – No vacunación obligatoria
Título: Vacunas Covid-19: consideraciones éticas, legales y prácticas
En esta resolución se puede leer en el punto 7.1.1 “garantizar ensayos de alta calidad, sólidos y realizados de manera ética de conformidad con las disposiciones pertinentes del Convenio para la Protección de los Derechos Humanos y la Dignidad del Ser Humano con respecto a la Aplicación de la Biología y la Medicina: Convenio sobre Derechos Humanos y Biomedicina (ETS nº 164, Convenio de Oviedo) y su Protocolo Adicional sobre Investigación Biomédica (CETS nº 195), y que incluyen progresivamente a los niños, las mujeres embarazadas y las madres lactantes;".
La sección 7.1.1 exige que se garanticen estudios éticos y de alta calidad de conformidad con las disposiciones pertinentes del Convenio para la Protección de los Derechos Humanos y la Dignidad de las Personas con respecto a las Aplicaciones de la Biología y la Medicina, de conformidad con el Convenio sobre Protección de los derechos humanos y la biomedicina (SEV N° 164, Convenio de Oviedo (Enlace) - PDF) y el Protocolo Adicional sobre Investigación Biomédica (SEV N° 195 (Enlace) - PDF), que incluye finalmente a niños, mujeres embarazadas y madres lactantes.
El Acuerdo de Oviedo CETS 164 (SEV 1164) de 4 de abril de 1997 establece en su Capítulo IV, Artículo 13, - "Intervenciones sobre el genoma humano - Una intervención que tenga por objeto modificar el genoma humano sólo podrá realizarse con fines preventivos,
fines diagnósticos o terapéuticos y sólo si su objetivo no es introducir modificación alguna en el genoma de ninguna descendencia”.
Aquí se define claramente que una intervención para cambiar el genoma humano es sólo con fines preventivos,
fines diagnósticos o terapéuticos y sólo si no tiene como objetivo cambiar el genoma de la descendencia.
Artículo 13 – Intervenciones sobre el genoma humano
Una intervención encaminada a modificar el genoma humano sólo podrá emprenderse con fines preventivos,
fines diagnósticos o terapéuticos y sólo si su objetivo no es introducir ninguna modificación en
el genoma de cualquier descendiente.
El punto 7.3.1 dice “garantizar que los ciudadanos estén informados de que la vacunación no es obligatoria y de que nadie está bajo presión política, social o de otro tipo para vacunarse si no desea hacerlo”.
En otras palabras, el objetivo es garantizar que los ciudadanos estén informados de que la vacunación NO es obligatoria y que nadie será presionado política, social o de otro modo para vacunarse si no desea hacerlo.
El punto 7.5.1 señala que “establecer programas independientes de compensación por vacunas para garantizar la compensación por los daños y perjuicios indebidos resultantes de la vacunación”; .
El punto 7.5.2 establece “utilizar los certificados de vacunación únicamente para el propósito designado de monitorear la eficacia de la vacuna, los posibles efectos secundarios y eventos adversos”;
Los certificados de vacunación están destinados únicamente al propósito de monitorear la efectividad de las vacunas, así como sus efectos secundarios y eventos adversos.
Además de esto, también vale la pena leer y prestar atención al resto de contenidos.
Portugal – 0,9 % muertes por Covid-19 en lugar de las 17.000 oficialmente
Gracias a una petición de la población portuguesa, el tribunal de Portugal tuvo que resolver la cuestión de cuántas personas fueron registradas como muertas por Covid-19 y oficialmente con alrededor de 17.000 Se estima que en realidad murieron de Covid-19.
El tribunal tomó pruebas y presentó su Veredicto del 19 de mayo de 2021 llegó a la conclusión de que solo 152 personas murieron por Covid-19.
Según la lectura habitual, toda persona fallecida que haya tenido una prueba PCR positiva en los últimos 28 días o esté registrada como persona de contacto debe computarse como muerte por Covid-19.
El 11 de noviembre de 2020, el Tribunal de Apelación de Lisboa ya había tramitado la demanda contra las medidas de cuarentena que se habían ordenado en base a los resultados de las pruebas PCR. Destacó en un documento de 34 páginas. Veredicto, según varias fuentes científicas, la orden de cuarentena por la dudosa validez del procedimiento de prueba PCR.
Punto de notificación para el esclarecimiento de muertes tras la vacunación CORONA
La unión Médicos y Científicos por la Salud, la Libertad y la Democracia eV ofrece en su sitio web una amplia gama de información, consejos y sugerencias sobre la autopsia de personas fallecidas tras la vacunación contra el coronavirus. Esto también está disponible para descargar aquí. PDF publicado. Se señala explícitamente, entre otras cosas, que la autopsia se realizó de acuerdo con las recomendaciones de
Profesor Dr. Arne Burkhardt
Laboratorio de patología de Reutlingen
Aguas superiores 3-7
72764 Reutlingen
se van a llevar a cabo.
La junta directiva de la asociación está formada por el Prof. Dr. medicina Sucharit Bhakdi, especialista en microbiología y epidemiología de infecciones, profesora emérita. de la Universidad Johannes Gutenberg de Maguncia, de 1991 a 2012 director del Instituto local de Microbiología e Higiene Médica, el Dr. medicina Ronald Weikl, ginecólogo, Prof. Dr. Stefan Homburg, Profesor de Finanzas Públicas, Universidad Leibniz de Hannover y Daniela Folkinger, Consultora Psicológica, Profesora, Thurmansbang.
Osteopatía y vacunación corona
Jens Oskamp*, osteópata de Colonia, ha escrito la siguiente información para pacientes, que se refiere a los riesgos de las vacunas de vectores y de ARNm en relación con el tratamiento osteopático y, por tanto, causa la exclusión de las personas vacunadas.
„Lamentablemente, debo informarles que no puedo tratar a personas que hayan recibido las llamadas vacunas de ARNm y vectores contra el SARS CoV2. A diferencia de las vacunas tradicionales, se trata de métodos de ingeniería genética que manipulan las propias células del cuerpo para producir por sí mismas partes de un virus con el objetivo de desencadenar una respuesta inmune del cuerpo. Estas “vacunas” sólo tienen aprobación de emergencia. Hay poca o ninguna investigación sobre reacciones cruzadas con otros medicamentos y terapias. (Vídeo – Prof. Dr. Hockertz, 2020)
A este respecto surgen los siguientes problemas para los tratamientos osteopáticos:
Aún no está claro qué zonas del cuerpo se ven afectadas por la formación de trombosis. La conocida trombosis de las venas cerebrales se produce como efecto secundario porque la sangre fluye relativamente lentamente en esta zona del cuerpo (Chen et al. 2021). Pero la sangre que fluye lentamente también ocurre en otras partes del cuerpo. Allí también se pueden formar trombos. (Kadkhoda, 2021). Si, por ejemplo, los vasos sanguíneos del sistema venoso de las piernas se vuelven más permeables mediante técnicas osteopáticas, los trombos que se han formado inicialmente pueden desprenderse, lo que en el peor de los casos puede provocar una embolia pulmonar. La formación de trombos suele ocurrir sin síntomas.
Además, no se puede descartar que puedan producirse más reacciones inmunitarias incontroladas en cuanto se liberen patógenos del tejido durante el tratamiento osteopático. Normalmente, el sistema inmunológico puede manejarlo fácilmente. Sin embargo, un sistema inmunológico hiperactivo puede provocar complicaciones graves y destruir el propio tejido del cuerpo (Vojdania y Kharrazianb, 2020), (Talotta, 2021).
Un buen tratamiento osteopático elimina las obstrucciones en el sistema linfático. Como resultado de la manipulación del ARNm, allí se almacena una cantidad antinatural de anticuerpos específicos (Habitación 2020). No se puede descartar que se produzcan reacciones importantes (Hotez et al. 2020) tan pronto como estos tejidos cambien como parte de un tratamiento osteopático. El sistema nervioso también puede verse afectado, como en los casos de parálisis fascial [parálisis facial] (Shemer et al. 2021),(Renould y otros, 2021) o problemas oculares debido a una Papilledema (Sociedad Alemana de Oftalmología, 2021) espectáculo.
Surgen otros problemas debido a las nanopartículas utilizadas en las vacunas de ARNm (Chen et al. 2021). Entre otras cosas, provocan la vacuolización (prácticamente la formación de edema a nivel celular) de determinados tipos de tejido, especialmente del hígado. Esta es una señal de que las células correspondientes han muerto como resultado de reacciones con nanopartículas (Vídeo – Dra. Vanessa Schmidt-Krüger, 2021*). Tampoco en este caso está claro qué sucede si el líquido de estos “edemas” o el tejido muerto llega al torrente sanguíneo mediante técnicas osteopáticas.
*Enlaces de descarga local a los videos del Dr. Vanessa Schmidt-Krüger son aquí (Vídeo 1_2) y aquí (Vídeo 2_2) disponible.
Si ya se ha sometido a modificaciones genéticas utilizando vacunas de ARNm/vectores, le pido que vuelva a concertar una cita conmigo no antes de 10 meses después de estas medidas. Luego discutiremos qué pruebas de laboratorio y procedimientos de imagen son necesarios para descartar complicaciones. (p.ej. examen de papiledema - Sociedad Alemana de Oftalmología, 2021)
Las inyecciones múltiples aumentan la intensidad y la probabilidad de las relaciones descritas anteriormente. Esto significa que me reservo el derecho de rechazar el tratamiento en general incluso después de un período de 10 meses.
¡¡¡Un sistema inmunológico fuerte como alternativa a la vacunación requiere conocimiento!!! Recomiendo el siguiente material de vídeo:
- Dr. rer. nat. Markus Stark – Fortalece el sistema inmunológico y las defensas
- Dr.med.Mathias Rath – Poner fin a la pandemia actual – ¡prevenga pandemias futuras!
- Profesor Dr. Jörg Spitz – Vitamina D – Hype or Hope„
- Sitio web de Jens Oskamp (actualmente en actualización)*
Modificación de la Ley básica y de protección contra infecciones
Con el publicado por el Bundestag alemán el 22 de junio de 2021 Impresos 19/30938 se convierte para el 23.07.2023 ¡la RESTRICCIÓN del derecho a la integridad física, que aún estaba garantizado por la constitución!
' Artículo 9
Cambio a la Ley de Protección contra Infecciones
Artículo 36, apartado 12 de la Ley de protección contra infecciones del 20 de julio de 2000 (BGBl.
I S. 1045), más recientemente por el artículo 1 de la Ley de 28 de mayo de 2021
(BGBl. I p. 1174) queda redactado como sigue:
“(12) Uno basado en el párrafo 8 oración 1 o el párrafo 10 oración 1
La norma legal emitida entra en vigor a más tardar un año después de la derogación de la
Determinación de la situación epidémica de interés nacional por parte del
Bundestag alemán inválido según el artículo 5, apartado 1, frase 2. hasta el suyo
Una disposición legal dictada sobre la base del párrafo 8 frase 1 o del párrafo 10 frase 1 puede modificarse incluso después de que se haya levantado la situación epidémica de importancia nacional.
Artículo 10
Restricción de derechos fundamentales
Por el artículo 9 se convierten en los derechos básicos de la integridad física (Artículo 2, apartado 2, frase 1 de la Ley Fundamental), libertad de la persona
(Artículo 2, apartado 2, frase 2 de la Ley Fundamental), libertad de circulación (Artículo 11
Apartado 1 de la Ley Fundamental) y la inviolabilidad del domicilio (artículo 13, apartado 1 de la Ley Fundamental) restringido.
7. El anterior artículo 9 pasa a ser el artículo 11 y su apartado 2 queda redactado de la siguiente manera:
(2) “Los artículos 1, 2, 6, 7 números 1, 2 y 4 así como el artículo 8 entrarán en vigor en julio de 2023”.
Evaluación de 109 estudios sobre el uso de mascarillas
El 20 de abril de 2021 se realizó una evaluación de 109 estudios sobre los aspectos de salud del uso de mascarillas en tiempos de pandemia. Revista Internacional de Investigación Ambiental y Salud Pública publicado, el aquí como PDF en el original (inglés) y aquí La versión alemana está disponible para descargar.
Los investigadores llegaron a un resultado que ellos mismos no creían posible dado este nivel de daño.
Además de los efectos negativos ya conocidos, cabe destacar el síndrome de agotamiento inducido por la mascarilla (MIES).
Los efectos de MIES pueden incluir problemas de concentración, pensamiento y habla, disminución de la frecuencia cardíaca y respiratoria y de la profundidad de la respiración, lo que a su vez puede causar daños a la sangre y las arterias coronarias y, como resultado, enfermedades neurológicas y cardíacas. Los efectos a largo plazo siguen siendo objeto de investigación en curso.
OMS – Cambio en las recomendaciones de vacunación para niños
En el versión Desde el 3 de junio de 2021, la recomendación era no vacunar a los niños por el momento, ya que todavía no había evidencia confiable para vacunar a los niños contra el Covid-19, sobre todo porque, al igual que los adolescentes, suelen tener casos más leves en comparación con los adultos. Aún así se deben continuar con las vacunas habituales recomendadas para los niños.
En el versión actual, publicado el 20 de junio de 2021, el pasaje anterior se ha modificado en el sentido de que, aunque se señalan los cursos más leves y no es necesario realizar una vacunación siempre que los niños no formen parte de un grupo de riesgo, más Todavía se necesita información para poder hacer recomendaciones generales de vacunación.
Sin embargo, Pfizer BioNTech se define como apto para niños mayores de 12 años. A los niños de entre 12 y 15 años como miembros de grupos de riesgo también se les debe ofrecer esta vacuna, junto con otros grupos prioritarios.
Al igual que en la versión anterior, se señala que todavía no hay suficientes datos de series de pruebas con niños. Tan pronto como haya más información disponible, se emitirán las recomendaciones apropiadas.
Los pasajes modificados están resaltados en amarillo en los documentos anteriores.
Alto Decisión del STIKO para la sexta actualización de la recomendación de vacunación COVID-19 y la justificación científica asociada en Boletín Epidemiológico 23/2021 Es aconsejable (de acuerdo con las recomendaciones actuales de la OMS) “vacunar a niños y adolescentes con enfermedades previas con la vacuna de ARNm Comirnaty (BioNTech/Pfizer) debido al supuesto mayor riesgo de un curso grave de la enfermedad COVID-19”. "Actualmente no se recomienda en general el uso de Comirnaty en niños y adolescentes de entre 12 y 17 años sin enfermedades previas, pero es posible tras consejo médico y con deseos individuales y aceptación de riesgos".
PEI – Informe de seguridad
El PEI (Instituto Paul Ehrlich), una agencia federal del Ministerio de Salud sujeta a instrucciones, publica cada varias semanas los llamados informes de seguridad sobre las vacunas utilizadas y sus efectos secundarios.
El RKI (Instituto Robert Koch), una autoridad federal superior independiente sujeta a instrucciones en el sentido de Art. 87 Apartado 3 Frase 1 GG. Es sede de “varias comisiones científicas, por ejemplo la Comisión Permanente de Vacunación, que desarrolla recomendaciones de vacunación. También es responsable del procesamiento del contenido y la coordinación de los informes sanitarios federales y de aprobar la importación y el uso de células madre de embriones humanos”.
Resumen de casos:
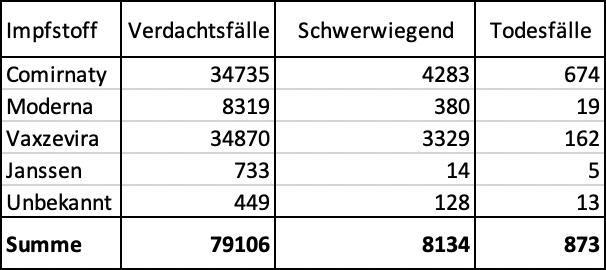
Puede encontrar más información sobre estas autoridades en el sitio web Ministerio Federal de Salud.
La base de datos de EE.UU. VAERS da los siguientes números para los EE.UU.:
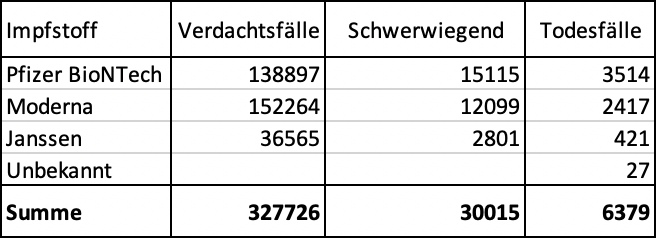
A modo de comparación: desde que comenzaron las vacunaciones contra la difteria, el sarampión, las paperas, la rubéola, la polio y el tétanos, han muerto 4.050 personas en Estados Unidos. La primera vacuna contra la difteria se aprobó por primera vez en Alemania en 1936, la vacuna contra el sarampión en Estados Unidos en 1963, la vacuna contra las paperas y la rubéola en 1969, la vacuna contra la polio en 1955 y la vacuna contra el tétanos en 1930.
Es decir, por parte del gobierno como “seguro” y “altamente eficaz” Las vacunas contra el Covid-19 declaradas, según los datos disponibles en EE.UU., han generado 150 % de estas muertes en seis meses (!), ¡algo que todas las vacunas antes mencionadas juntas no han logrado en seis u ocho décadas!
Efectividad de las vacunas Covid-19
A partir del 1 de junio de 2021, el RKI anunció en sus preguntas frecuentes sobre las vacunas de ARNm: “Aún no se sabe cuánto dura la protección de la vacunación. La protección no comienza inmediatamente después de la vacunación y algunas personas vacunadas quedan desprotegidas”.
Respecto a las vacunas basadas en vectores se informa lo siguiente: “Aún no se sabe cuánto dura la protección de la vacunación. La protección no comienza inmediatamente después de la vacunación y algunas personas vacunadas quedan desprotegidas”.
Esto plantea la cuestión de hasta qué punto los “efectos secundarios adversos” y las “muertes” registrados en los informes de seguridad de PEI u otras bases de datos pueden justificarse si se admite abiertamente que no se proporciona protección inmediata ni después de múltiples vacunaciones. información disponible sobre la duración de la posible protección.
Publicaciones archivadas:
Preguntas frecuentes – Pruebas de corona
Publicación del 31 de marzo de 2021 08:43
Las “pruebas” son un compañero casi diario en estos días. Y a menudo surge la pregunta de qué, qué prueba se prueba, cómo y con qué importancia. A continuación se muestra una lista de los procedimientos y propiedades de prueba disponibles:
prueba de PCR
... se utiliza para detectar el ARN del SARS-CoV-2, es decir, partes del material genético del virus Covid-19, pero no para detectar el virus activo, es decir, reproducible.
Para la detección mediante una línea de fluorescencia específica, es necesario duplicar el material genético contenido en la muestra. La frecuencia de las ejecuciones de reproducción se refleja en el llamado valor Ct (valor umbral del ciclo).
Lo ideal es que este valor de Ct esté documentado en el informe del laboratorio.
Una prueba de PCR positiva con un valor de Ct de 30...35 indica una carga viral baja, y un valor de Ct >35 indica una carga viral muy baja.
Un valor Ct de 25, por ejemplo, representa una carga viral significativa. (Fuente: Prueba de PCR – Relevancia del valor Ct)
Sin embargo, dado que en la práctica los valores de Ct no están documentados ni manejados de forma estandarizada por los diferentes laboratorios, y algunos trabajan con valores de Ct de 40 o superiores (hasta 50), los resultados de las pruebas de PCR no son comparables ni significativos. . El riesgo de resultados falsos positivos aumenta a medida que aumenta el valor de Ct, con todas las consecuencias negativas la lanceta informado en relación con una investigación en el Reino Unido.
No en vano las recomendaciones son: OMS El resultado de una prueba de PCR siempre debe evaluarse en relación con los síntomas de la enfermedad y el diagnóstico clínico existentes.
prueba de antígeno
... está destinado a detectar una infección aguda (estructuras proteicas del virus corona), pero requiere una carga viral elevada. Por lo tanto, se requiere confirmación mediante una prueba de PCR posterior (con un valor de Ct bajo).
Una lista de aquellos en Alemania con aprobación especial (Vence a mediados de mayo de 2021.) Las pruebas de antígenos comercializadas se pueden encontrar en el sitio web del “Instituto Federal de Medicamentos y Productos Sanitarios (BfArM”) BfArM – Pruebas de antígenos con aprobación especial.
La prueba puede dar lugar a resultados falsos positivos si el equipo de prueba se ha almacenado por debajo de la temperatura de almacenamiento recomendada y luego se utiliza.
Prueba de anticuerpos (muestra de sangre – prueba Elisa / prueba rápida)
... detectar anticuerpos específicos que fueron producidos por el organismo en respuesta al virus corona.
Es irrelevante si la respuesta inmune (formación de los anticuerpos detectados) se debió a una infección previa por Covid-19 o a una vacunación contra Covid-19.
Entrevista al Dr. Greiner, diagnóstico de laboratorio, Viena
Covid-19 – Qué pueden decir los anticuerpos.
¿Erradicar el Covid-19?
Publicación del 31 de marzo de 2021 09:06
¿Es posible erradicar un virus?
– ¿Cuánto tiempo pasó hasta que el virus del sarampión fue (a mitad de camino) “derrotado”?
La primera vacuna contra el sarampión con una vacuna fraccionada inactivada se aprobó en los EE. UU. en 1963 y se ha desarrollado continuamente. Sin embargo, después de casi 60 años, el sarampión todavía no ha sido erradicado (fuente: Virus del sarampión).
– ¿Cuánto tiempo tardó en erradicar el virus de la polio?
La primera vacuna contra la polio con un virus inactivado se administró por primera vez en 1955 (fuente: Vacunación contra la polio), le siguió un segundo en 1960. La OMS declaró erradicada la polio en 2015, 60 años después (!).
Y hoy se cree que las vacunas desarrolladas en unos pocos meses, que utilizan tecnologías de vectores o ARNm, no han sido probadas con éxito en animales, ni en humanos con estudios de fase I.. III diseñados convencionalmente, sobre sus efectos secundarios y efectos secundarios a largo plazo. efectos No hay ninguna declaración y los productos sólo se comercializaron con una aprobación de emergencia, que no se indica en los formularios de consentimiento, de que son capaces de vencer o incluso erradicar un virus, ¡y eso en unos pocos meses!
De manera análoga a los virus de la polio y el sarampión, se puede suponer que el Covid-19 tardará no menos de dos generaciones en ser erradicado, o al menos bajo control.
¿Quieren seguir imponiendo el confinamiento, la vacunación obligatoria (todavía sólo de forma indirecta), la cuarentena, el aislamiento, la exigencia de mascarilla, etc., hasta el certificado de vacunación digital incluido?
La única forma eficaz garantizada de erradicar el virus sigue siendo un confinamiento que dure casi 60 años o eliminar el huésped del virus, es decir, exterminar a todas las personas. Entonces se elimina la supervivencia del virus.
Por cierto: esto también explica que un virus siempre se esfuerza por no matar a su huésped para poder seguir multiplicándose. Por tanto, las mutaciones siempre perseguirán el objetivo de reproducirse de forma optimizada, pero sin volverse más peligrosas para su huésped. No hay duda de que los virus aún pueden ser mortales para personas que ya han estado enfermas.
¿Cómo entender los vaivenes del gobierno?
Publicación del 03. Abril 2021 22:11
Antes de intentar abordar esta pregunta para encontrar una de las posibles respuestas, es útil imaginarse a sí mismo en 2012.
El Bundestag alemán encargó en 2012 un “análisis de riesgos en materia de protección civil”, cuyo informe se publicó el 3 de enero de 2013 en el impreso 17/12051, que se puede encontrar en Informe de análisis de riesgos – impreso 17/12051 v. 01/03/2013 Se puede acceder y descargar como PDF.
En el Capítulo 2.3 en la página 5 puede encontrar el tema “Análisis de riesgos “Pandemia causada por el virus Modi-SARS”.
A esto le siguió un documento de 17 páginas titulado "Cómo controlar el COVID-19", clasificado como "información clasificada sólo para uso oficial", que todavía estaba disponible en el sitio web del Ministerio Federal del Interior el 20 de mayo de 2020. Cómo controlamos el COVID-19 estaba disponible y descargable. Hoy ya no es accesible allí, sino a través de este enlace de respaldo. Documento clasificado sobre el escenario del COVID-19 del Ministerio Federal del Interior.
De esto se derivan todas las acciones anteriores, presentes y futuras del gobierno federal en relación con el COVID-a9.
Los esfuerzos actuales del gobierno por limitar paso a paso la influencia de todas las instituciones anteriores en las decisiones de la Canciller, excluirlas, privar al poder legislativo de su función constitucionalmente consagrada y los cambios estructurales de personal en los tribunales de la República Federal de Alemania, apuntan a la dirección que ya comenzó en 1933. ¡Esta vez, sin embargo, no hay aliados disponibles para hacer posible implementar una nueva ley básica que ponga fin precisamente a este esfuerzo!
EMA – fondos
Publicación del 20 de abril de 2021 02:43
Aquí se presentan las conexiones entre la función de la EMA (Agencia Europea de Medicamentos) y la carrera, así como los conflictos de intereses resultantes, de la presidenta de la EMA, Emer Cooke, como informó epochtimes.de el 7 de abril de 2021: La presidenta de la EMA, Emer Cooke, fue durante años lobista de la organización farmacéutica más grande de Europa.
exceso de mortalidad
Publicación del 20 de abril de 2021 08:09
Siempre feliz de abordar el tema del exceso de mortalidad. Además de la falta de capacidad de camas de cuidados intensivos, el argumento del exceso de mortalidad es un compañero constante para justificar las medidas del gobierno.
Se podría pensar que las cifras de la Oficina Federal de Estadística también deberían conocerse en las conferencias de prensa federales (ver: Cifras de fallecidos en marzo de 2021: 11 % por debajo del promedio de años anteriores).
Sin embargo, Hanno Kautz, portavoz del Ministro de Sanidad, Jens Spahn, sabe Conferencia de prensa federal el 19 de abril de 2021 Nada sobre estos números. A la pregunta del Sr. Reitschuster: “Señor Kautz, según la Oficina Federal de Estadística, el mes pasado tuvimos una tasa de mortalidad baja. En marzo, murieron un 11 por ciento menos que el promedio de los años 2017 a 2020. ¿Cómo se explica eso?", simplemente responde: "No comento cifras que no haya visto antes". y "Citas un número muy concreto, que no sé, cuyo contexto desconozco. No puedo comentar sobre eso en este momento”.
Surge la pregunta: si estas cifras son tan poco interesantes y la gente ni siquiera las ha notado o las conoce, ¿por qué se citan constantemente como justificación para medidas cada vez más estrictas?